Новости медицины и производства лекарственных средств. Механизмы действия лекарственных средств
В основе механизма действия ЛС, как правило, лежит их способность инициировать (запускать) сложные биохимические н/или биофизические процессы, которые в конечном итоге изменяют и/или оптимизируют функциональную активность клетки-мишени.
Лекарственные средства могут реализовывать свое действие в отношении органов и/или клеток-мишеней путем:
Прямого химического взаимодействия;
Физико-химического взаимодействия на мембране клетки;
Действия на специализированные ферменты;
Действия на регуляторные гены;
Действия на специфические рецепторы.
Прямое химическое взаимодействие ЛC. Этот механизм действия ЛС встречается достаточно редко и может реализоваться вне клетки, например, в просвете желудка или кишечника. Суть его заключается в том, что ЛС вступает в прямую химическую реакцию с молекулами и/или ионами, образующимися в организме в норме иди при патологическом состоянии. Примером прямого химического взаимодействия может служить химическая реакция нейтрализации соляной кислоты желудка при приеме антацидиых ЛС (см. Т. 2, с. 112).
Физико-химическое взаимодействие ЛС па мембране клетки. Одной из основных функций цитоплазматической мембраны является осуществление ионного обмена между цитоплазмой и внеклеточной средой. Трансмембранный ионный обмен может осуществляться в том числе и через специальные потенциалзависимые трансмембранные ионные каналы - натриевые, калиевые, кальциевые, хлорные и т.д. Некоторые лекарства, достигая клеточной мембраны, взаимодействуют е этими каналами и изменяют их функциональную активность. Так, например, в основе антиаритмического действия препарата IA класса - хинидина - лежит его способность блокировать прохождение ионов Na + через трансмембранные натриевые каналы (см. Т. 2, с. 35).
Действие ЛС на специализированные ферменты. Относительно небольшое количество ЛС реализует свой фармакологический эффект путем изменения активности некоторых специализированных клеточных ферментов. Лекарственные средства, повышающие активность клеточных ферментов, называют индукторами ферментов. Таким действием обладает, например, снотворный и противосудорожный препарат фенобарбитал, который значительно усиливает активность микросомальных ферментов печени. Биологическое значение этого эффекта фенобарбитала и близких к нему Л С будет рассмотрено далее.
Лекарственные средства, угнетающие активность специализированных ферментов, называют ингибиторами ферментов. Так, например, антидепрессант из группы ингибиторов моноаминооксидазы (МАО) препарат пирлиндол реализует свое антидепрессивное действие путем подавления активности фермента МАО в ЦНС (см. Т. 1, с. 294).
Способность ингибировать активность фермента ацетилхолинэстеразы лежит в основе фармакологической активности антихолинэстеразных ЛС, например физостигмина. Известно, что в физиологических условиях ацетилхолинэстераза инактивирует (разрушает) ацетилхолин - нейромедиатор, передающий возбуждение в синапсах парасимпатической нервной системы. Физостигмин, подавляя активность ацетилхолинэстеразы, способствует накоплению в синапсах парасимпатической системы нейромедиатора ацетилхолина, в результате чего тонус парасимпатической нервной системы повышается, что на системном уровне проявляется развитием брадикардии, снижением артериального давления (АД), усилением моторики желудочно-кишечного тракта (ЖКТ), сужением зрачка и т.д.
Лекарственные средства могут взаимодействовать с ферментами обратимо и необратимо. Так, например, препарат эналаприл обратимо ингибирует активность ангиотензинпревращающего фермент, что влечет за собой, в частности, понижение АД, тогда как фосфорорганические отравляющие вещества необратимо подавляют активность ацетилхолинэстеразы.
Действие ЛС на регуляторные гены. В настоящее время ученые предпринимают попытки создания ЛС, реализующих свои фармакологические эффекты путем прямого воздействия на физиологическую активность регуляторных генов. Особенно перспективным это направление представляется после того, как в 2000 г. была расшифрована структура генома человека. Полагают, что избирательная нормализация функции регуляторных генов под воздействием ЛС позволит добиться успеха в лечении многих, в том числе ранее неизлечимых, болезней.
Действие ЛС на рецепторы. Прежде чем перейти к особенностям взаимодействия ЛС с рецепторами, необходимо уточнить, что мы понимаем под термином «рецептор» (от лат. recipio - брать, принимать).
Из курса физиологии известно, что под термином «рецептор» понимают высокоспециализированные образования, способные воспринимать, трансформировать и передавать энергию внешнего сигнала в нервную систему. Такие рецепторы называют сенсорными (от лат. sensus - чувство, ощущение, восприятие).
К сенсорным рецепторам относятся рецепторы органов слуха, зрения, обоняния, вкуса, осязания и т.д. Сенсорные рецепторы этих органов относятся к так называемым экстерорецепторам.
Если наличие органов чувств, реагирующих на внешние стимулы раздражения, было известно с давних времен, то наличие сенсорных рецепторов и внутри организма подвергалось сомнению вплоть до середины XIX в. Впервые о наличии такого рода рецепторов и внутри организма высказал предположение русский физиолог И.Ф.Пион, показавший в 1866 г. падение АД вследствие раздражения аорты в опыте на кролике. Это открытие дало начало для поиска и изучения рецепторов, расположенных внутри организма, а сами эти рецепторы получили название интерорецепторов.
К началу XX в. было выявлено достаточное количество сенсорных интерорецепторов и доказана их важная роль в регуляции физиологических функций организма.
В 1905 г. Дж. Лэнгли (J. Langley) доказал, что при нанесении ЛС на клеточную мембрану фармакологический эффект развивается в том случае, если оно нанесено только на определенный ее участок. Причем этот участок составляет лишь небольшую часть общей площади клеточной поверхности. Это наблюдение позволило Дж. Лэнгли сделать заключение о том, что на клеточной мембране существуют специализированные рецепторные участки, взаимодействующие с ЛС.
Однако приоритет в создании рецепторной теории действия ЛС принадлежит немецкому физиологу П.Эрлиху (P.Ehrlich), который в 1906 г. впервые ввел термин «рецептор» и сформулировал постулат «лекарственное вещество не действует, если не фиксируется на мембране клетки». Согласно теории П.Эрлиха, молекула ЛС имеет две функционально активные группы, одна из которых обеспечивает его фиксацию на поверхности клетки в области лекарственного рецептора, а вторая функциональная группа взаимодействует с рецептором и запускает сложную цепь биохимических реакций, обеспечивающих изменение ее (клетки) физиологической активности.
Таким образом, еще в начале XX в. стало очевидно, что существует, как минимум, два класса интерорецепторов: сенсорные рецепторы, осуществляющие передачу информации о состоянии внутренних органов и тканей организма в ЦНС; меточные рецепторы, которые взаимодействуют с ЛС, изменяющими функциональную активность клеток-мишеней.
Сразу же следует оговориться, что в дальнейшем в тексте учебника во избежание путаницы в терминологии рецепторы для ЛС и биологически активных веществ, т.е. меточные, или циторецепторы. будут обозначаться термином «рецептор», тогда как сенсорные интерорецепторы будут обозначаться термином, характеризующим их функциональную активность, например, «барорецепторы», «болевые рецепторы» и т.д.
Открытие П.Эрлихом на клеточной мембране рецепторов для ЛС послужило отправной точкой для развития фармакологической науки, в частности фармакодинамики, одной из основных задач которой является изучение рецепторных механизмов действия ЛС.
В настоящее время выявлена структура большого числа клеточных рецепторов, особенности взаимодействия с ними тех или иных биологически активных соединений, что позволило, с одной стороны, понять механизм действия известных ЛС, а с другой стороны, явилось основой для создания новых высокоэффективных ЛС.
Естественно, трудно себе представить, что в организме человека в процессе эволюции образовались рецепторы к различным синтетическим (полученным химическим путем) ЛС, тем более, что подавляющее большинство представленных на современном фармацевтическом рынке ЛС были синтезированы в последние 50 лет и менее. Доказано, что рецепторный аппарат клетки - очень древнее функционально-структурное образование. Так, а- и β-адренорецепторы (рецепторы, взаимодействие с которыми норадреналина и адреналина влияет на функциональную активность клетки) обнаружены не только в клетках животных, но и на клеточных мембранах клеток растений, например в клетках растения ниттела, где а- и β-адренореценторы регулируют движение протоплазмы (содержимою клетки).
Тогда что же представляют собой рецепторы для ЛС, открытые П. Эрлихом, и почему с ними они взаимодействуют?
В настоящее время не вызывает сомнений, что так называемые лекарственные рецепторы на самом деле являются рецепторами для эндогенных (вырабатываемых в организме) биологически активных веществ, участвующих в регуляции функциональной активности внутренних органов и тканей организма. К таким биологически активным соединениям относятся вещества, выделяющиеся из нервных окончаний в момент передачи нервного сигнала, а также гормоны, витамины, аминокислоты и т.д. Для каждого эндогенного биологически активного вещества существуют строго специфичные для него рецепторы. Так, например, вырабатываемое в организме биологически активное вещество адреналин может активировать строго специфичные для него а- и β-адренорецепторы, а глюкокортикостероиды - гормоны коры надпочечников - взаимодействуют только со строго специфичными для них глюкокортикостероидными рецепторами.
Синтетические ЛС, реализующие свои эффекты путем взаимодействия с рецепторным аппаратом клетки, по своей химической структуре в той или иной мере подобны эндогенным биологически активным соединениям, взаимодействующим с аналогичными рецепторами. Так, например, синтетическое вазоконстрикторное (вызывающее сужение сосудов) ЛС фенилэфрин но своей химической структуре близок к эндогенному биологически активному веществу норадреналину, поэтому гак же как и норадреналин, обладает способностью стимулировать а-адренорецепторы.
Иногда в связи с особенностями своего химического строения ЛС могут взаимодействовать не с самим рецептором, а с прилежащим к нему участком клеточной мембраны. Так как в данном случае ЛС взаимодействует не с самим рецептором, а с прилегающим к нему участком клеточной мембраны, говорят не о возбуждающем или блокирующем влиянии на рецептор, а об аллостерическом (от греч. alios - другой, иной) воздействии, или эффекте. В результате может происходить изменение как структуры прилежащей к рецептору мембраны, так и отдельных компонентов самого рецептора, что может повлечь за собой изменение чувствительности рецептора к специфичному для него биологически активному веществу. В тех случаях, когда чувствительность рецептора к биологически активному веществу повышается, говорят о сенситизации (от лат. sensus - чувство) или о сенсибилизации (от лат. sensibilis - чувствительность) рецептора, а в тех случаях, когда чувствительность рецептора понижается, говорят о десенситизации рецептора.
Особенность аллостерического воздействия заключается в том, что ЛС, обладающее такого рода механизмом действия, непосредственно на передачу нервною импульса не влияет, но видоизменяет ее в желаемом направлении. Например, в основе механизма действия анксиолитиков (противотревожных ЛС; син.: транквилизаторы), по своей химической структуре являющихся производными бензодиазепина, лежит феномен аллостерического возбуждения постсинаптических бензодиазепиновых рецепторов. Возбуждение последних в свою очередь, способствует активации тормозных постсинаптических рецепторов гамма-аминомасляной кислоты (ГАМК-рецепторов), что клинически проявляется устранением таких симптомов невротических заболеваний, как чувство беспокойства, тревоги, страха и т.д.
Рецепторы, взаимодействуя с которыми, биологически активное вещество или ЛС каким-либо образом изменяет функциональное состояние клетки-мишени, называют специфическими.
Помимо специфических рецепторов, выделяют так называемые неспецифические для ЛС рецепторы. В специальной медицинской литературе эти рецепторы также называют «местом потери» ЛС. Связываясь с такими рецепторами, лекарства не оказывают какого-либо биологического эффекта, а сами становятся биологически неактивными. Примером такого вида рецепторов могут служить рецепторы, расположенные на белках плазмы крови, в частности, на водорастворимых белках - альбуминах. Значение этого феномена будет подробно рассмотрено далее (см. Т. 1, с. 72).
Структура рецепторов достаточно сложна, но большинство из них представляют собой белковые макромолекулы или гликопротеины, в состав которых могут также входить ионы, липиды, нуклеиновые кислоты и т.д. Рецептор, т.е. образующая его белковая макромолекула, характеризуется определенным, специфическим для каждого рецептора пространственным расположением входящих в него химических групп. Белковая макромолекула, образующая рецептор, может быть интегрирована (погружена) в липидный бислой цитоплазматической мембраны или локализоваться внутри клетки. Основной функцией клеточного рецептора является «распознавание» химического сигнала, передающегося ему посредством эндогенного биологически активного вещества и/или ЛС и трансформация его н соответствующий биохимический и/или биофизический ответ клетки.
Ранее полагали, что ЛС или эндогенные биологически активные вещества взаимодействуют с рецепторами по типу «ключ и замок», т.е. рецептор имеет такую структуру, которая позволяет ЛС находить «свой» рецептор, соединяться с ним и как бы «включать» и «выключать» его. Однако с развитием медицинской науки стало очевидно, что эго не совсем так. В настоящее время уже достаточно хорошо изучены особенности молекулярных процессов превращения внеклеточных сигналов во внутриклеточные, регулирующие функцию клетки, т.е. механизмы, в результате которых реализуется эффект взаимодействия эндогенных биологически активных веществ или ЛС с рецепторами.
При взаимодействии с рецептором эндогенного биологически активного вещества и/или подобно ему действующего Л С происходит конформация - пространственное изменение формы - белковой макромолекулы, что является пусковым механизмом для различных внутриклеточных процессов, определяющих реакцию клетки-мишени на медиатор и/или ЛС. Например, активация адренорецепторов гладких мышц бронхов под влиянием β 2 -адреностимулятора фенотерола влечет за собой повышение активности фермента аденилатциклазы, который способствует накоплению в клетке циклического аденозинмонофосфата (цАМФ) и, как следствие этого, расслаблению клетки.
В общем биологическом плане клеточные рецепторы можно рассматривать как строго специализированные «органы чувств» клеток, посредством которых они воспринимают «информацию», исходящую, например, из ЦНС и/или эндокринной системы. Несмотря на столь важную роль рецепторного аппарата, рецепторы занимают лишь незначительную часть мембраны клеток. Например, М-холинорецепторный аппарат клетки занимает не более 1/6 000 площади ее поверхности.
Изучение особенностей взаимодействия ЛС с рецептором, с одной стороны, позволяет понять основу молекулярного механизма его действия, а с другой стороны, позволяет получить информацию о том, какие изменения следует провести в структуре ЛС, чтобы усилить его способность взаимодействовать с данным рецептором, т.е. позволяет вести целенаправленный синтез новых высокоэффективных ЛС.
В физиологических условиях разные клеточные рецепторы функционируют не самостоятельно, а находятся в постоянном взаимодействии друг с другом, регулируя тем самым специфическую активность клетки. Так, например, активация β-адренорецепторов сердечной клетки эндогенным норадреналином вызывает, в частности, учащение числа сердечных сокращений, а активация М-холинорецепторов сердечных клеток эндогенным ацетилхолином, напротив, вызывает урежение числа сердечных сокращений.
Большой вклад в понимание рецепторных механизмов действия ЛС внесло открытие пре- и постсинаптических рецепторов. Синапс (от греч. synapsis - соединение, связь) представляет собой специализированную зону контакта между нервными клетками или другими возбудимыми структурами организма, обеспечивающую передачу приходящей информации и сохранение ее информационной значимости. Изучение структуры и функциональной роли синапсов было начато в конце XIX в. после тою, как испанский гистолог С. Рамон-н-Кахаль (S.Ramon у Cajal) высказал предположение о наличии в ЦНС специализированной передающей системы. Свое название синапсы получили в 1897 г., когда английский физиолог Ч.Шеррингтон (Ch.Sherrington) предложил этот термин для обозначения зоны контакта между нервными клетками.
В настоящее время выделяют три вида синапсов:
1) «электрические» синапсы, в которых передача информации осуществляется путем перехода электрического сигнала с пре- на постсинаптическую мембрану. Такой вид синапсов носит название эфапс (от греч. ephapsis - плотный контакт);
2) «химические» синапсы, в которых передача информации осуществляется посредством специальных биологически активных веществ - нейромедиаторов (от греч. neuron - нерв и лат. mediator - посредник; син.: медиатор);
3) «смешанные» синапсы, в которых передача информации осуществляется и химическим, и электрическим путем.
Фармакологические эффекты подавляющего большинства ЛС, влияющих на функции синапсов, реализуются путем их воздействия на гот или иной этап передачи сигнала в химических синапсах, т.е. в синапсах второго вида.
Как правило, химические синапсы классифицируют по нейромедиаторам, осуществляющим в них передачу нервного импульса, следующим образом:
Синапсы, в которых в качестве медиатора выступает ацетилхолин, называют холинергическими;
Синапсы, в которых в качестве медиатора выступают адреналин и норадреналин, называют адренергическими;
Синапсы, в которых в качестве медиатора выступают АТФ и аденозин, называют пуринергическими;
Синапсы, в которых в качестве медиатора выступает гаммааминомасляная кислота, называются ГАМК-ергические и т.д.
Структура синапса в настоящее время достаточно хорошо изучена. Синапс состоит из пресинаптического отростка нервной клетки (окончания аксона) и воспринимающего «сигнал» аппарата, расположенного на мембране эффекторной («исполнительной») клетки.
Аксон эфферентного нейрона, подходя к эффекторной клетке, теряет миелиновую оболочку, расширяется и образует так называемое пресинаптическое утолщение (рис. 1.5). Поверхность нервного окончания, обращенная к клеточной мембране эффекторной клетки, называется пресинаптической мембраной. Участок эффекторной клетки, расположенный напротив пресинаптической мембраны, называется постсинаптической мембраной (см. рис. 1.5). В зависимости от особенностей строения синапса, пресинаптическая мембрана может иметь большее или меньшее количество складок и тем самым имеет большую или меньшую площадь. В химических синапсах пресинаптическая мембрана непосредственно не контактирует с постсинаптической мембраной, а отстоит от нее на небольшом расстоянии, которое называется синаптической щелью (см. рис. 1.5).
Пресинаптическое утолщение, т.е. концевой участок аксона, содержит большее по сравнению с телом нейрона количество митохондрий - внутриклеточных органелл, участвующих в синтезе и накоплении энергии, что свидетельствует об интенсивности энергетических процессов, протекающих в этом отделе нервной клетки. Помимо митохондрий, пресинаптические утолщения содержат большое количество маленьких пузырьков - везикул. В среднем в одном пресинаптическом утолщении содержится около 20 000 везикул. Последние локализованы в пресинаптическом утолщении неравномерно, как правило, большая их часть расположена около пресинаптической мембраны. Нейромедиатор синтезируется в теле и аксоне нейрона и накапливается в везикулах. Каждая везикула содержит несколько тысяч молекул нейромедиатора (от I 000 до 50 000). При возникновении нервного импульса везикула сливается с пресинаптической мембраной и нейромедиатор выделяется в синаптическую щель (см. рис. 1.5).
Рис. 1.5. Принципиальная схема строения «химического» синапса:
а - схематичное изображение; б - электронная микрофотография; 1- пресинаптическое нервное окончание; 2 - прссинаптическая мембрана; 3 - постсинаптическая мембрана; 4 - синаптическая щель; В - везикула; НМ - нейромедиатор; Р - постсинаптический рецептор: ОЗ - «обратный» захват нейромедиатора; СФ - специализированный фермент, разрушающий избыток нейромедиагора в синапт ической щели
На постсинаптической мембране располагаются функционально-активные образования рецепторы, которые способны взаимодействовать с нейромедиатором, высвобождающимся из пресинаптической мембраны при прохождении нервного импульса. Рецепторы, расположенные на постсинаптической мембране, в специальной медицинской литературе называют синаптическими, или постсинаптическими, рецепторами. Под постсинаптическими рецепторами понимают встроенные в постсинаптическую мембрану макромолекулы белковой природы с генетически предопределенными структурой и функцией, способные за счет функциональных групп активного центра («узнающего» участка макромолекулы) обратимо взаимодействовать с нейромедиаторами и/или ЛС.
Передача нервного сигнала в синапсе происходит следующим образом: под воздействием нервного стимула везикулы перемещаются к пресинаптической мембране и нейромедиатор путем экзоцитоза выделяется в синаптическую щель (см. рис. 1.5). Выделившийся в синаптическую щель нейромедиатор достигает постсинаптической мембраны, где, взаимодействуя с постсинаптическим рецептором, запускает цепь биохимических и/или биофизических реакций, результатом которых является физиологический ответ клетки-мишени. Однако далеко не все количество выделившегося нейромедиатора достигает постсинаптических рецепторов и взаимодействует с ними. Часть нейромедиатора захватывается пресинаптической мембраной и «возвращается» к местам хранения. Этот феномен носит название феномена обратного захвата («reuptake») нейромедиатора.
Оставшееся количество не вступившего невзаимодействие с рецептором нейромедиатора разрушается в синаптической щели специализированными ферментами. Этот феномен носит название деградации нейромедиаторов. Например, фермент ацетилхолинэстераза катализирует (ускоряет) процесс деградации (разрушения) в синаптической щели нейромедиатора ацетилхолина.
В отличие от нейромедиатора продукты его метаболизма ие обладают нейромедиаторной активностью. Весь процесс взаимодействия нейромедиатора с рецепторами и разрушение его избытка специфическим ферментом крайне короток и не превышает 2 мс (1 мс = 0,001 с).
Столь малая продолжительность этого процесса объясняется, с одной стороны, крайне быстрым высвобождением нейромедиатора из связи с рецептором, а с другой стороны, высокой скоростью ферментативной инактивации нейромедиатора в синаптической шели.
Принципиально функциональную активность синапса можно изменить следующим образом:
Ускорить, уменьшить или блокировать синтез, накопление и/или катаболизм (разрушение) нейромедиатора в пресинаптическом окончании. В результате этого каким-либо образом изменится содержание нейромедиатора и, как следствие этого, интенсивность его физиологической активности.
Например, симпатолитик резерпин препятствует накоплению катехоламинов н синаптических пузырьках вплоть до полного их опустошения. В результате количество нейромедиатора норадреналина, выделяющегося в синаптическую щель, резко падает. На системном уровне этот эффект реализуется в виде снижения АД. Некоторые ЛС непосредственно на содержание нейромедиаторов в пресинаптическом окончании не влияют, но подавляют активность ферментов, их разрушающих. Таким образом действует ряд антидепрессантов. Например, антидепрессант пирлиндол ингибирует (подавляет) в пресинаптическом окончании активность фермента моноаминоксидазы и, как следствие этого, повышает концентрацию в нем таких нейромедиаторов, как норадреналин, дофамин, серотонин. Клинически этот эффект пирлиндола проявляется уменьшением чувства тревоги и страха, улучшением настроения, повышением физической активности и т.д.;
Изменить (облегчить, затруднить) способность нейромедиатора проникать через пресинаптическую мембрану и, следовательно, увеличивать или уменьшать количество нейромедиатора, выделяющегося в синаптическую щель при каждом импульсе.
Например, психостимулятор амфетамин облегчает высвобождение катехоламинов в адренергических синапсах ЦНС и тем самым увеличивает их содержание в синаптической щели. Клинически такое действие препарата проявляется в улучшении настроения, ощущением прилива сил, повышением работоспособности. Токсин столбняка блокирует в ЦНС высвобождение тормозных нейромедиаторов (ГАМК, глицин) и тем самым резко уменьшает их содержание в синаптической щели, что клинически проявляется развитием судорог;
Блокировать или стимулировать обратный захват (reuptake) нейромедиаторов пресинаптической мембраной и, следовательно, повышать или понижать концентрацию нейромедиаторов в синаптической щели.
Например, трициклический антидепрессант имипрамин блокирует обратный захват пресинаптической мембраной нейромедиатора норадреналина и тем самым резко повышает его концентрацию в синаптической щели. Клинически этот эффект имипрамина проявляется улучшением настроения, повышением психической и физической активности;
Стимулировать или блокировать активность ферментов, разрушающих нейромедиатор в синаптической щели.
Например, антихолинэстеразный препарат физостигмин снижает активность фермента ацетилхолинэстеразы, разрушающего в синаптической щели нейромедиатор ацетилхолин, и тем самым способствует увеличению его концентрации, что клинически может проявляться, в частности, понижением внутриглазного давления и сужением зрачка.
Стимулировать или блокировать постсинаптические рецепторы, т.е. имитировать или блокировать эффект нейромедиаторов.
Например, наркотические анальгетики, которые возбуждают постсинаптические опиоидные рецепторы и тем самым имитируют аффект нейромедиаторов - энкефалинов. Стрихнин, блокируя рецепторы тормозного нейромедиатора глицина, препятствует реализации его тормозного влияния, в результате стрихнин в высоких дозах вызывает судороги.
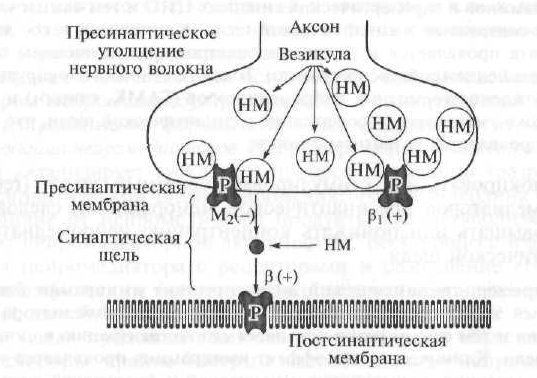
Рис. 1.6. Схематичное изображение локализации пре- и постсинаптических рецепторов на примере адренергического синапса (пояснение в
НМ - нейромедиатор; M 2 (-) - холинергический «тормозной» пресинаптический гетерорецептор; β 1 (+) - адренергический «активирующий» пресинаптический ауторецептор; β - адренергический постсинаптический рецептор
Помимо рецепторов, расположенных на постсинаптической мембране, т.е. постсинаптических рецепторов, в структуре синапса выделяют рецепторы, локализованные на пресинаптической мембране, т.е. пресинатпические рецепторы (рис. 1.6). Несмотря на то, что и пре-, и постсинаптические рецепторы могут возбуждаться одним и тем же нейромедиатором, функциональная роль этих рецепторных образований в синапсах различна. Если постсинаптические рецепторы являются конечным звеном для передачи нервного импульса на эффекторный орган, т.е. обеспечивают однонаправленное проведение нервного импульса от центра к периферии, то пресинаптические рецепторы принимают участие в
регуляции нейромедиаторной активности синапса, т.е. в определенной мере влияют на процессы высвобождения и/или синтеза в нем нейромедиатора. Необходимо подчеркнуть, что пресинаптические рецепторы непосредственного участия в проведении нервного импульса с нейрона на эффекторный орган не принимают.
Пресинаптические рецепторы подразделяют на две большие группы: ауто- и гетеронейромодуляторные рецепторы (см. рис. 1.6).
К пресинаптическим ауторецепторам относятся рецепторы, которые возбуждаются собственным для данного синапса нейромедиатором.
Например, в синапсах, локализованных в области контакта соматических нервов с поперечнополосатой мышцей, при избыточном содержании в синаптической щели нейромедиатора ацетилхолина, он, взаимодействуя с пресинаптическими ауторецепторами, тормозит высвобождение новой порции нейромедиатора, т.е. возбуждение пресинаптических ауторецепторов регулирует высвобождение из пресинапгических окончаний ацетилхолина.
Однако на пресинаптической мембране, помимо ауторецепторов, т.е. рецепторов, чувствительных к нейромедиатору, осуществляющему передачу возбуждения в данном синапсе, могут располагаться рецепторы, не чувствительные к нейромедиатору, осуществляющему передачу возбуждения в данном синапсе, а взаимодействующие с другим типом нейромедиатора.
Например, на пресинаптической мембране синапса, в котором нейромедиатором является ацетилхолин, могут располагаться пресинаптические рецепторы, чувствительные к нейромедиатору норадреналину. Такой тип пресинаптических рецепторов носит название гетеронейромодулирующих рецепторов.
Таким образом, синапс представляет собой сложное анатомофункциональное образование, обеспечивающее передачу нервного импульса с нейрона на нейрон или с нейрона на эффекторную клетку.
Последовательность функциональной активности синапса (этапы синаптической передачи) выглядит следующим образом:
Синтез и накопление нейромедиатора в везикулах, локализованных в пресинаптических утолщениях (синтез нейромедиатора происходит не только в пресинаптических утолщениях, а также в нейроне и аксонах);
Высвобождение нейромедиатора в синаптическую щель в момент прохождения нервного импульса;
Взаимодействие нейромедиатора с постсинаптическими рецепторами, что влечет за собой активацию рецепторов и изменение функциональной активности эффекторной клетки;
Инактивация нейромедиатора (ферментативная) и/или его обратный захват пресинаптической мембраной, т.е. восстановление способности синапса вновь передавать нервный импульс на эффекторную клетку.
Синапсы обладают следующими основными свойствами:
Одностороннее проведение возбуждения (нервный импульс может проходить только от пресинаптической мембраны к постсинаптической);
Синаптическая задержка, т.е. на передачу нервного импульса в синапсе затрачивается определенное время. (Скорость синаптической передачи в среднем более чем в 10 раз меньше, чем скорость распространения нервного импульса по нерву. Для химического синапса она обычно колеблется в пределах 0,2 -0,5 мс);
Повышенная утомляемость - постепенное снижение или полное прекращение передачи нервного импульса при продолжительной нервной стимуляции. В основе этого феномена лежит, с одной стороны, истощение запасов нейромедиатора в пресинаптических утолщениях, а с другой - уменьшение чувствительности к нейромедиатору постсинаптических рецепторов;
Высокая чувствительность синаптических образований к ЛС и ядам.
Именно на последнем свойстве синапсов и основывается вся фармакология ЛС, оказывающих влияние на функциональную активность синапсов, расположенных в различных органах и тканях организма. Необходимо подчеркнуть, что объектом фармакологическою воздействия может быть любой из этапов синаптической передачи. В качестве ЛС, влияющих на синаптическую передачу, используют экзогенные аналоги нейромедиаторов, их химические предшественники и другие биологически активные вещества, способные каким-либо образом изменять функциональную активность синапса.
Необходимо отметить, что многие ЛС имеют не одну, а несколько точек приложения эффекта на уровне синапса. Так, например, антидепрессант пирлиндол не только ингибирует активность фермента моноаминооксидазы в синаптической щели, но и блокирует обратный захват норадреналина пресинаптической мембраной.
По отношению локализации рецептора к синапсу их можно подразделить на пресинаптические, постсинаптические и внесинаптические. К последним, например, относятся рецепторы, расположенные на клеточных мембранах тромбоцитов.
С точки зрения клеточной топографии (местоположения) рецепторы можно классифицировать и по их расположению на клеточных структурах следующим образом:
мембранные рецепторы - рецепторы, расположенные на цитоплазматической мембране;
цитозольные рецепторы - рецепторы, расположенные на внутриклеточных образованиях;
ядерные рецепторы - рецепторы, расположенные на мембране ядра клетки.
Как уже было отмечено ранее, в результате взаимодействия с рецептором эндогенных биологических веществ или ЛС происходит изменение функциональной активности клеток-мишеней. Этот процесс может быть реализован разными путями, строго определенными для различных типов рецепторов. В соответствии с этим в настоящее время выделяют четыре типа рецепторов, каждому из которых присущ свой, принципиально отличающийся от других механизм, путем которого сигнал с рецептора инициирует каскад биохимических и/или биофизических реакций, приводящих к изменению функционального состояния клеток-мишеней.
Первые три типа рецепторов локализованы на клеточной (цитоплазматической) мембране, а к четвертому типу рецепторов относятся цитозольные и ядерные рецепторы.
К I типу рецепторов относятся клеточные (мембранные) рецепторы, реализующие свои эффекты через так называемые сигнальные G-белки (рис. 1.7).
На первом этапе биологически активное вещество или ЛС, «подойдя» к клеточной мембране, «распознает» рецептор и взаимодействует с ним, после чего рецептор активирует специализированный сигнальный G-белок, расположенный на внутренней поверхности мембраны. Далее активированный G-белок изменяет функциональную активность внутреннего эффекторного элемента, в качестве которого, как правило, выступают ферменты. Затем эффекторный элемент, являющийся ферментом, активирует вторичный посредник, или вторичный мессенджер, который и запускает каскад биохимических реакций, изменяющих функциональную активность клеток-мишеней.
Клеточные рецепторы I типа, т.е. рецепторы, сопряженные с сигнальными G-белками, структурно схожи между собой, а по своей пространственной организации являются серпантинной (от фр. serpantine - змея, клубок) структурой (рис. 1.8).
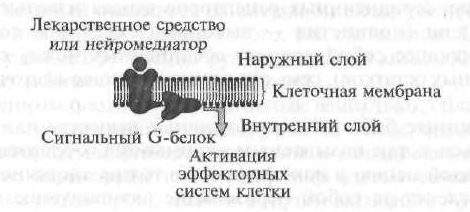
Рис. 1.7. Схема строения рецептора 1 типа (пояснение в тексте)
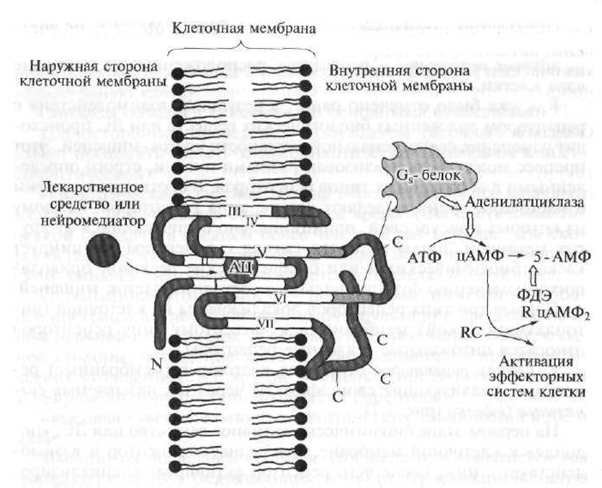
Рис. 1.8. Схематическое изображение структуры «серпантинового»
рецептора:
N - полипептидная часть рецептора, расположенная над клеточной мембраной; С - полипептидная часть рецептора, расположенная под клеточной мембраной; АЦ - активный центр рецептора, с которым взаимодействует лекарственное средство иди нейромедиатор; АТФ - аденозинтрифосфат - вторичный мессенджер; цАМФ - циклический аденозинмонофосфат; 5-АМФ - аденозин-5"-монофосфат; ФДЭ - фосфодиэстераза; R. RC - цАМФ-зависимый фермент (протеинкиназа) с регуляторной и каталитической (ускоряющей реакцию) субъединицами; 1-VII - полипептидные цепи серпантинового рецептора
В состав серпантинных рецепторов входят извитые полипептидные цепи (полипептид - высокомолекулярное соединение, представляющее собой цепочку соединенных между собой аминокислотных остатков), семь раз пронизывающие клеточную мембрану.
Эндогенные биологически активные вещества или ЛС могут связываться с так называемым «карманом», образованным полипептидной цепью и находящимся в толще клеточной мембраны, что влечет за собой образование активирующего сигнала, который передается на участки цепи рецептора, находящиеся в цитоплазме клетки. Сигнальные G-белки взаимодействуют с ци-
стольными (внутриклеточными) участками пол и пептидной цепи; активизируют и запускают о клетке-мишени каскад биохимических реакций, изменяющих ее функциональную активность, т.е. инициируют первичный фармакологический ответ.
В настоящее время известно несколько видов сигнальных G -белков.
Сигнальные G,-белки. Эти сигнальные белки, как правило, активируют эффекторный элемент - фермент аденилатциклазу, который в свою очередь стимулирует синтез в клетке (из АТФ) вторичного мессенджера - циклического аденозин монофосфата (цАМФ). Биологическая роль цАМФ как вторичного мессенджера очень важна. Так, например, повышение его содержания в клетках сердца влечет за собой увеличение частоты и силы сердечных сокращений. Помимо этого, увеличение концентрации цАМФ в различных клетках-мишенях вызывает расслабление гладкой мускулатуры сосудов и бронхов, мобилизацию энергетических запасов (распад углеводов в печени), подавляет агрегационную способность тромбоцитов, понижает тонус миометрия (мышцы матки) и мочевого пузыря и т.д.
К эндогенным биологически активным веществам, обладающим способностью активизировать сигнальные G s -белки, относится ряд нейромедиаторов - адреналин (путем активации β-адренорецепторов), дофамин (путем активации D 1 -дофаминовых рецепторов), аденозин (путем активации аденозиновых А 2 -рецепторов), гистамин (путем активации гистаминовых Г 2 -ренептороп), серотонин (путем активации серотониновых 5-НТ 4 -ренепторов), а также ряд гормонов, например, вазопрессин (путем стимуляции V 2 -вазопрессиновых рецепторов) и т.д.
Сигнальные G i -белки. В отличие от сигнальных G s -белков активация сигнальных G i -белков не стимулирует, а подавляет активность эффекторного элемента - фермента аденилатциклазы, что влечет за собой уменьшение концентрации в клетках-мишенях вторичного мессенджера - цАМФ. Уменьшение содержания цАМФ в клетках-мишенях вызывает снижение силы сердечных сокращений, увеличение тонуса сосудов и бронхов, т.е. эффект, обратный тому, который оказывает на клетки-мишени увеличение содержания в них цАМФ. Помимо этого, ряд сигнальных G i -белков принимает участие в регуляции функциональной активности трансмембранных ионных Са 2+ - и К + -каналов.
К эндогенным биологически активным веществам, обладающим способностью активизировать сигнальные G i -белки, относится ряд нейромедиаторов, например, адреналин и норадреналин (путем активации а 2 -адренорецспторов), дофамин (путем активации D 2 - дофаминовых рецепторов), аденозин (путем активации А 1 -аденозиновых рецепторов), ацетилхолин (путем активации М 2 - и М 4 -мускариновых рецепторов) и др.
Сигнальные G^-белки. Эти сигнальные белки способствуют активизации другого эффекторного элемента клеток-мишеней - фермента фосфорилазы С, который в свою очередь стимулирует образование в клетках-мишенях вторичных мессенджеров - диацилглицерола (ДАГ) и инозитол-1,4,5-трифосфата (ИТФ). Первый из них (ДАГ) связан с клеточной мембраной и инициирует биохимические реакции, принимающие участие в регуляции сократительного статуса, роста и деления клеток, секреции клетками-мишенями некоторых гормонов. Под влиянием фермента фосфолипазы А 2 ДАГ может метаболизироваться до арахидоновой кислоты, принимающей участие в синтезе таких биологически активных веществ, как эйкозаноиды - простагландини, простациклины, громбоксаны, лейкотриены (см. Т. I, с. 478).
Второй вторичный мессенджер - ИТФ - не фиксируется на клеточной мембране и перемещается во внутриклеточную среду (цитозоль), где он инициирует выделение ионов Са 2 + из клеточных депо, т.е. способствует переходу неактивных ионов Са 2+ в активную форму.
Многие исследователи рассматривают ионы Са 2+ как третичный мессенджер, или посредник. Это обусловлено тем, что роль ионов Са 2+ в регуляции функциональной активности клеток очень важна. Ионы Са 2 + могут попадать в клетку из внешней среды через специальные трансмембранные ионные каналы и/или высвобождаться из клеточных депо. Основным депо (местом накопления неактивных ионов Са 2+) в клетке является эндоплазматический, или саркоплазматический, ретикулум (reticulum sarcoplasmaticunr, син.: эндоплазматическая сеть - внутриклеточная органелла, представляющая собой расположенную в цитоплазме систему канальцев и цистерн, ограниченную мембраной; принимает участие в обеспечении транспорта веществ в цитоплазме). Поступившие из саркоплазматического ретикулума в цитоплазму свободные (активные) ионы Са 2+ взаимодействуют с некоторыми Са 2+ -связывающими белками, важнейшими из которых является кальмодулин. Комплекс «кальмодулин -Са 2+ » и/или комплексы ионов Са 2+ с другими кальцийсвязывающими белками запускают в клетке каскад биохимических реакций. В результате в зависимости от органов-мишеней, в которых этот процесс происходит, инициируются усиление сократительной функции миокарда и скелетной мускулатуры, повышение тонуса гладкой мускулатуры сосудов, бронхов, матки, увеличение секреторной активности железистой ткани, стимуляция высвобождения нейромедиаторов из нервных окончаний и т.д. Также доказано, что ионы Са 2+ обладают способностью повышать активность ферментов, участвующих в белковом, углеводном и жировом обмене.
Помимо прямой взаимосвязи между вторичными мессенджерами - ДАГ и ИТФ и, следовательно, сигнальными G q -белками, у ионов Са 2 + в физиологических условиях существует достаточно сложное взаимодействие со вторичным мессенджером цАМФ, активность которого регулируют сигнальные G s - и G i -белки. Так, показано, что свободные ионы Са 2+ , поступающие в цитоплазму нервной клетки через систему «кальмодулин - Са 2+ », инициируют снижение содержания иАМФ в клетке. Вместе с тем для поддержания в открытом состоянии кальциевых ионных каналов в клетке необходимы высокие концентрации цАМФ, т.е. инициируемое комплексом «кальмодулин - Са 2+ » снижение содержания цАМФ влечет за собой прекращение поступления свободных ионов Са 2+ в цитоплазму. С другой стороны, есть данные о том, что вторичный мессенджер цАМФ усиливает поглощение свободных ионов Са 2+ саркоплазматическим ретикулумом, т.е. способствует переходу ионов Са 2+ из свободной, активной формы в связанную, неактивную форму.
В результате повышения содержания в клетках-мишенях вторичных мессенджеров - ДАГ и ИТФ - возрастает тонус гладкой мускулатуры, увеличивается секреция желез, облегчается высвобождение нейромедиаторов из пресинаптических окончаний, повышается агрегационная способность тромбоцитов и т.д.
К эндогенным биологически активным веществам, обладающим способностью активировать сигнальные С q -белки, относятся такие нейромедиаторы, как норадреналин (путем активизации а 1 -адренорецепторов), ацетилхолин (путем активизации мускариновых М 1 и М 3 - рецепторов), серотонин (за счет активизации серотониновых 5-НТ 2а -рецепторов), гистамин (за счет активизации гистаминовых Н 1 -рецепторов), а также другие эндогенные биологически активные вещества, например, брадикинин и ангиотензин.
В настоящее время, помимо перечисленных сигнальных G-белков (G s , G|, G q), выявлены и другие сигнальные G-белки - G s , G i , G q , физиологическая роль которых до настоящего времени остается окончательно неясной. Но вместе с тем имеются данные о том, что, например, сигнальный С o -белок принимает участие в регуляции функциональной активности трансмембранных ионных каналов.
Функциональной единицей рецепторов 11 типа является трансмембранный (пронизывающий всю толщу клеточной мембраны) белок (фермент). Сам рецептор состоит из двух одинаковых фрагментов, которые называются мономерами. Мономеры расположены на незначительном расстоянии друг от друга, а сам мономер состоит из двух функционально активных субъединиц - доменов, соединенных между собой полипептидным сегментом, пересекающим липидный бислой мембраны (рис. 1.9). а-Субъединица мономера выступает над наружной поверхностью мембраны и ответственна за связывание рецептора с биологически активными веществами, а Р-субъединица погружена в цитоплазму клетки.
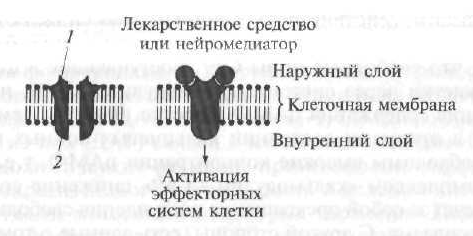
Рис. 1.9. Схема строения рецептора II типа (пояснение в тексте): 1 - а-субъединица мономера; 2 - β-субъединица мономера
После связывания биологически активного вещества с а-субъединицей рецептора рецептор переходит из неактивного мономерного состояния в активное димерное состояние, при котором два мономера объединяются в плоскости мембраны (см. рис. 1.9). При этом происходит стимуляция ферментативной активности цитоплазматической β-субъединицы рецептора, в результате в клетке-мишени запускается каскад биохимических реакций, изменяющих ее функциональное состояние.
В качестве трансмембранного фермента, образующего рецептор, как правило, выступают такие ферменты, как тирозинкиназа или гуанилатциклаза.
Примером тирозинкиназного рецептора могут служить инсулиновые рецепторы (см. Т. 1, с. 435).
Гуанилатциклазный путь передачи сигнала начинается с взаимодействия а-субъединицы рецептора с эндогенным биологически активным веществом, например с предсердным натрийуретическим фактором (ANF), представляющим собой биологически активное вещество, секретируемое клетками предсердий и принимающим участие в регуляции силы сердечных сокращений. В результате этого взаимодействия происходит изменение конфигурации рецептора, заключающееся в объединении составляющих его мономеров в димер. Этот процесс активирует ферментную часть рецептора, расположенную в его цитозольной β-субъединице, т.е. фермент гуанилатциклазу, который в свою очередь способствует повышению концентрации в клетке-мишени вторичного мессенджера циклического гуанидин-3,5"-монофосфата (цГМФ). Повышение концентрации цГМФ в клетках-мишенях запускает каскад биохимических реакций, изменяющих их функциональное состояние, например расслабление гладкомышечных клеток сосудов.
К рецепторам Ш типа относятся рецепторы, которые под влиянием эндогенных биологически активных веществ - нейромедиаторов обеспечивают прохождение соответствующих ионов через клеточную мембрану, что приводит к изменению ее (мембраны) электрического заряда (потенциала).
По структуре рецепторы III тина представляют собой канал, пронизывающий липидный бислой клеточной мембраны, образованный несколькими полипиптедными единицами (рис. 1.10). Например, никотиновый (Н) рецептор представляет собой канал диаметром 8 нм, образованный пятью полипептидными субъединицами (а - две, β, γ, d) (см. рис. 1.10). При взаимодействии нейромедиатора ацетилхолина с выступающим над поверхностью клеточной мембраны участком (доменом) - а-субъединицей рецептора - происходит изменение его структуры и открывается центральный канал, по которому ионы Na + согласно градиенту концентрации поступают внутрь клетки-мишени, что влечет за собой изменение ее функциональной активности. Помимо Н-холинорецепторов, к рецепторам III типа относятся рецепторы для гамма-аминомасляной кислоты и возбуждающих аминокислот.
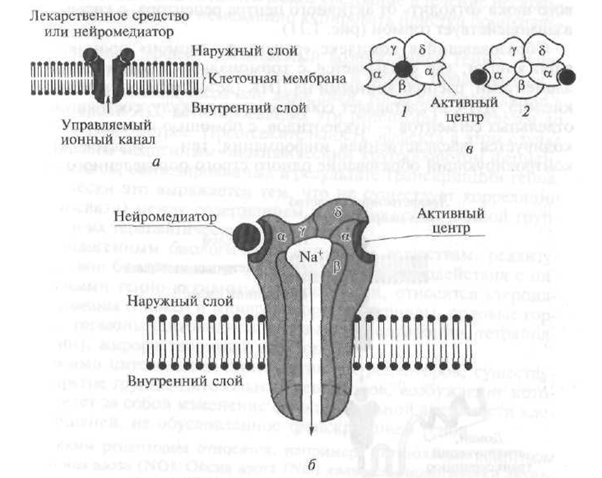
Рис. 1.10. Схема строения рецептора 111 типа:
a - принципиальная схема; б - трансмембранный ионный канал (в разрезе); в - трансмембранный ионный канал (вид сверху); / - канал в неактивном (закрытом) состоянии; 2 - канал в активном (открытом) состоянии; а. β, γ, d - полипептидные субъединицы канала
К рецепторам IV типа относятся внутриклеточные и ядерные рецепторы. Биологически активные вещества, взаимодействующие с этим типом рецепторов, представляют собой липофильные (легко растворимые в жирах) соединения, поэтому легко проникают через клеточную мембрану и достигают специфичных для них внутриклеточных рецепторов. К внутриклеточным рецепторам относятся рецепторы для гормонов, а также других биологически активных веществ.
Механизм взаимодействия гормонов с внутриклеточными рецепторами достаточно сложен, однако схематически его можно представить следующим образом. По структуре внутриклеточный рецептор для гормонов представляет собой полипептид, состоящий из нескольких функциональных единиц - доменов. В отсутствие гормона рецептор находится в неактивном состоянии благодаря тому, что его активный центр заблокирован специализированным белком - так называемым белком теплового шока. В том случае, когда к рецептору «подходит» гормон, белок теплового шока «отходит» от активного центра рецептора, с которым и взаимодействует гормон (рис. 1.11).
Образовавшийся комплекс «рецептор-гормон» проникает в ядро клетки, где связывается с гормонально-чувствительными элементами, расположенными на ДНК (дезоксирибонуклеиновая кислота; ДНК представляет собой макромолекулу, состоящую из отдельных сегментов - нуклеотидов, с помощью которых в генах кодируется наследственная информация; ген - участок ДНК, контролирующий образование одного строго определенного бел-
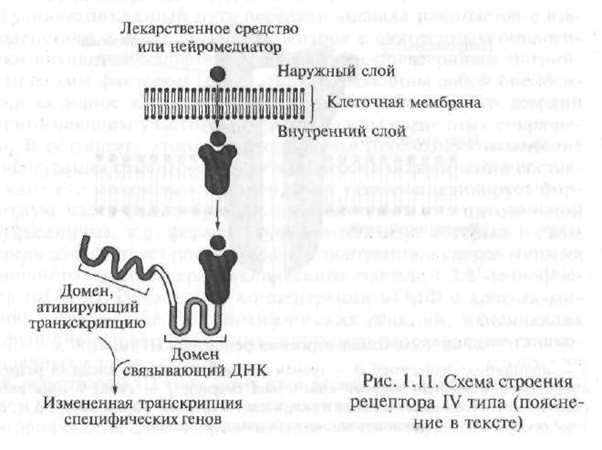
Рис. 1.11. Схема строении рецептора IV типа (пояснение в тексте)
ка). В результате этого взаимодействия запускается процесс транскрипции гена - процесс переноса содержащейся в генетическом коде информации с молекулы ДНК на молекулу информационной РНК (иРНК, син.: матричная РНК - мРНК). Транскрипция является первым этапом образования белков в клетке. Образовавшаяся иРНК. покидает ядро клетки и перемещается к рибосомам - внутриклеточным органеллам, ответственным за синтез белка в клетке. В специальной медицинской литературе рецепторы, активация которых вызывает процесс транскрипции генов, относят к гак называемым генно-активным рецепторам.
Как правило, ответ клеток-мишеней на возбуждение генно-активных рецепторов развивается достаточно медленно, что имеет очень важное клиническое значение.
Во-первых, ответ клеток-мишеней отсрочен во времени, гак как требует синтеза новых белков, на что, как правило, уходит 20-30 мин, т.е. гормоны, активируя рецепторы IV типа, не в состоянии изменить патологическое состояние в течение нескольких минут, например немедленно купировать приступ бронхиальной астмы.
Во-вторых, эффект, вызываемый возбуждением генно-активных рецепторов, достаточно длителен и может продолжаться в течение нескольких часов или даже дней, тогда как содержание в плазме крови ЛС, активировавших эти рецепторы, снижается до нуля гораздо быстрее. Продолжительность эффекта в этом случае обусловлена медленным биохимическим кругооборотом ферментов и белков, синтезированных в результате транскрипции генов. Клинически это выражается тем, что не существует корреляции (взаимосвязи) между содержанием в плазме крови данной группы ЛС и их терапевтическим эффектом.
К эндогенным биологически активным веществам, реализующим свои биологические эффекты путем взаимодействия с цитозольными генно-активными рецепторами, относятся стероидные гормоны (глюко- и минералокортикостероиды, половые гормоны), гормоны щитовидной железы (трийодтиронин, тетрайодтиронин), жирорастворимый витамин D.
Помимо цитозольных генно-активных рецепторов, существуют и другие группы цитозольных рецепторов, возбуждение которых влечет за собой изменение функциональной активности клеток-мишеней, не обусловленное транскрипцией генов.
К таким рецепторам относятся, например, цитозольные рецепторы для оксида азота (N0). Оксид азота (N0) является биологически активным веществом, образующимся в эндотелии сосудов. Как эндогенное биологически активное вещество оксид азота был впервые выделен из порты кролика американским физиологом Р.Фуршгстгом (R.F. Furchgott) в 1987 г. и получил название «эндотелиальный релаксирующий фактор - ОРФ». Оксид азота является липофильным соединением, легко проникающим через клеточную мембрану, где взаимодействует со специфичными для него цитозольными рецепторами, что влечет за собой активизацию фермента гуанилатциклазы. Последняя в свою очередь стимулирует синтез вторичного мессенджера цГМФ, который запускает каскад внутриклеточных биохимических реакций, приводящих к расслаблению клеток-мишеней - гладкомышечных клеток сосудов.
Таким образом, в настоящее время выделено четыре принципиальных механизма и соответственно им IV тина рецепторов, благодаря взаимодействию с которыми эндогенные биологически активные вещества и/или их синтетические аналоги, т.е. ЛС, могут воздействовать на функциональное состояние клеток-мишеней.
Однако это не означает, что количество известных рецепторов для биологически активных веществ ограничено числом 4. Их неизмеримо больше. Это обусловлено тем, что посредством одного и того же принципиального механизма действия на функциональную активность клеток может влиять очень большое количество разнообразных по химическому строению эндогенных биологических веществ. Например, различные по своему химическому строению и, следовательно, по рецепторам, с которыми они взаимодействуют, нейромедиаторы норадреналин и гистамин передают возбуждающий сигнал клеткам-мишеням посредством одного и того же принципиального механизма - стимуляции активности сигнальных G-белков, т.е. оба взаимодействуют с рецепторами I типа.
Поэтому все известные в настоящее время рецепторы классифицируют исходя не только из особенностей передачи сигнала на внутриклеточные структуры клеток-мишеней, но и из названий тех эндогенных биологически активных веществ, с которыми они специфически взаимодействуют.
Следует отметить, что рецепторы получили свое наименование с учетом названий эндогенных биологически активных веществ, с которыми взаимодействуют, задолго до того, как стали известны механизмы передачи сигналов на клетки-мишени.
К эндогенным биологически активным веществам, реализующим свои эффекты посредством взаимодействия со специфичными для них рецепторами, относятся нейромедиаторы (ацетилхолин, норадреналин, дофамин, гистамин, серотонин и др.), гормоны, биологически активные вещества тканевого происхождения - аутокаиды (простагландины, тромбоксаны, лейкотриены, брадикинин, ангиотензин и др.). В специальной медицинской литературе все эти вещества часто объединяют под термином «лиганды» (от лат. ligo - связывать, т.е. вещество, способное связываться с рецептором).
Таким образом, свое название рецепторы получают по названию специфичных для них лигандов. Например, рецепторы для нейромедиатора дофамина называют дофаминовыми, гормона инсулина - инсулиновыми, аугокаида лейкотриена - лейкотриеновыми и т.д.
В дальнейшем в тексте учебника во избежание путаницы в терминах в тех случаях, когда речь будет идти о механизме передачи сигнала с рецептора на внутриклеточные образования, будет использоваться термин «тип рецептора», а если речь будет идти о названии рецептора, обусловленном взаимодействующим с ним лигандом, будет применяться термин «вид рецептора».
Как правило, многие рецепторы одного вида подразделяют на несколько подвидов, например, адренорецепторы подразделяются на а- и β-адренорецепторы, холинорецепторы - на М- и N-холинорецепторы и т.д. В большинстве случаев подвиды также подразделяют на более мелкие группы: β 1 - и β 2 -адренорецепторы, N n - и N m -холинорецепторы и т.д.
Выявление подвидов рецепторов и изучение механизмов, благодаря которым эндогенные биологически активные вещества взаимодействуют с ними, имеет очень важное значение для современной фармакологии, так как позволяет создавать ЛС, взаимодействующие со строго определенным подвидом рецептора. Так, например, подразделение β-адренорецепторов на β 1 (преимущественно локализованные на клеточной мембране клеток сердца) и β 2 (локализованы, например, на клеточных мембранах гладкомышечных клеток бронхов), позволило создать ЛС, избирательно влияющие на сердечную мышцу (β 1 -адреностимуляторы) - препарат нонахлазин, и избирательно влияющие на гладкую мускулатуру бронхов (β 2 -адреностимуляторы) - препарат сальбутамол и т.д.
Необходимо отметить, что органы и ткани организма содержат не постоянное количество рецепторов и/или их подвидов, т.е. оно вариабельно. Изменять количество рецепторов в органе могут как патологические процессы, так и ЛС.
Например, ишемическая болезнь сердца сопровождается увеличением количества (3-адренорецепторов в сердечной мышце, а у пациентов, страдающих гипертонией, увеличивается количество как а-, так и β-адренорецепторов. Антидепрессант имипрамин при длительном применении уменьшает количество β-адренорецепторов в ткани головного мозга. Таких примеров можно привести достаточно много.
Сродство эндогенных (вырабатываемых в организме) нейромедиаторов или ЛС к рецепторам характеризуется термином «аффинность», а быстроту и прочность их связывания с рецепторами обозначают термином «аффинитет».
Естественно, что взаимодействие лекарственных средств с рецептором является не самоцелью, а должно приводить к какому-либо изменению в деятельности органов или тканей организма.
Такое изменение, или реакция, соответствующая функциональной значимости этого рецептора, получило название внутренней активности ЛС.
Лекарственные средства, обладающие внутренней активностью и аффинитетом к рецептору, являются агонистами, т.е. действуют подобно эндогенным биологически активным веществам.
Например, стимулятор а-адренорецепторов фенилэфрин оказывает на артериолы действие, аналогичное нейромедиатору норадреналину, т.е. он является агонисгом а-адренорецепторов. В специальной медицинской литературе, помимо термина «агонист», иногда используют термин «стимулятор рецепторов», или «миметик», например адреномиметик, т.е. ЛС, стимулирующее адренорецепторы.
Лекарственные средства, обладающие аффинитетом к рецептору, но препятствующие взаимодействию с рецептором экзогенных и эндогенных агонистов, называют антагонистами.
Например, блокатор М-холинорецепторов атропин препятствует взаимодействию с М-холинорецептором нейромедиатора ацетилхолина; блокатор (J-адренорецепторов пропранолол, блокируя β 2 -адреноструктуры легких, препятствует стимулирующему влиянию на них β 2 -адреностимулятора сальбутамола, т.е. атропин и пропранолол являются антагонистами соответствующих рецепторов.
В специальной медицинской литературе, помимо термина «антагонист» достаточно часто используют термин «блокаторы рецепторов» или «литики», например холинолитики, т.е. лекарственные средства, блокирующие холинорецепторы.
Схематически взаимодействие рецепторов с агонистами и антагонистами изображено на рис. 1.12.
Агонисты могут оказывать на рецептор как прямое, так и непрямое, т.е. опосредованное действие.
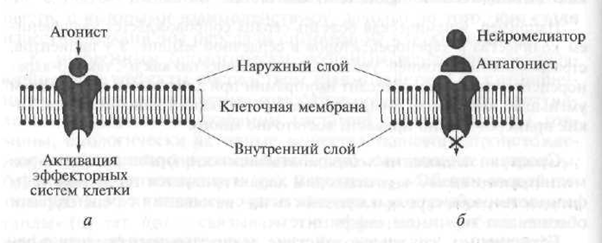
Рис. 1.12. Схема взаимодействия рецептора с агонистом (а) и антагониста (6) с рецептором (пояснение в тексте)
Например, агонист опиоидных рецепторов - препарат морфин - реализует свои аффекты путем непосредственной стимуляции (мю) р-, (каппа) к- и (дельта) 8-опиоидных рецепторов, т.е. оказывает на них прямое стимулирующее действие, тогда как симпатомиметик эфедрин реализует свои клеточные эффекты путем непрямого или опосредованною возбуждения а- и β-адренорецепторов: способствует вытеснению нейромедиатора норадреналина из пресинаптических нервных окончаний, тормозит его обратный захват нервными окончаниями, повышает чувствительность а- и p-адренорецепторов к норадреналину и адреналину и стимулирует выделение адреналина из коры надпочечников. Таким образом, эфедрин реализует свои фармакологические эффекты не прямо, а посредством нейромедиатора, при этом сам с рецептором напрямую не взаимодействует.
Антагонисты, так же как и агонисты рецепторов, могут реализовывать свои фармакологические эффекты прямо или опосредованно, блокируя соответствующие рецепторы.
Например, блокатор Н 3 -гистаминовых рецепторов желудка - препарат ранитидин - непосредственно взаимодействует с Н 2 -гистаминовыми рецепторами желудка, подавляет базальную секрецию соляной кислоты, препятствуя взаимодействию с рецептором эндогенного нейромедиатора гистамина, т.е. напрямую блокирует рецептор, тогда как симпатолитик резерпин, попадая в организм, подобно симпатомимстику эфедрину «выбрасывает» нейромедиатор норадреналин из пресинаптических окончаний, параллельно блокируя синтез новых «порций» норадреналина, что приводит к быстрому истощению запасов медиатора в пресинаптических окончаниях. В результате создается такое состояние, когда а-адренорецепторы сосудов «не работают» из-за отсутствия их физиологического стимулятора норадренапина. Можно говорить о том, что симпатолитик резерпин вызывает функциональную, опосредованную блокаду а-адренорецепторов.
Некоторые ЛС сочетают свойства агонистов и антагонистов, т.е. в определенных условиях возбуждают или блокируют одни и те же рецепторы. В тех случаях, когда в фармакологическом эффекте лекарства преобладает стимулирующий компонент, говорят, что препарат является частичным или парциальным, агонистом.
Механизм действия частичных, или парциальных, агонистов заключается в том, что эти ЛС, подходя к рецептору, фиксируются на нем. Однако в связи с особенностями своей химической структуры, возбуждают его таким образом, что вызывают не полный, а лишь частичный стимулирующий ответ. В то же время они препятствуют взаимодействию с этим рецептором других ЛС и/или соответствующего нейромедиатора.
Например, к частичным агонистам относится препарат налорфин, который применяют для лечения передозировки наркотических анальгетиков. Налорфин, «подойдя» к опиоидному рецептору, вытесняет из связи с ним морфин, т е. купирует агонистическое действие морфина на рецептор. Связываясь с рецептором, налорфин в незначительной мере оказывает на него стимулирующее действие, которое не в состоянии подавить активность дыхательного центра, т.с. оказывает частичное агонистическое действие на опиоидный рецептор, параллельно с этим блокирует его для морфина, тем самым проявляя антагонистическое действие по отношению к морфину. Неудобство налорфина заключается в том, что в случае передозировки его стимулирующее действие на рецептор усиливается и он угнетает дыхательный центр, так же как и морфин.
В тех случаях, когда в фармакологическом эффекте ЛС преобладает блокирующее действие, говорят, что препарат является антагонистом с собственной или внутренней активностью.
Особенности механизма действия антагонистов с собственной активностью можно рассмотреть на примере β 1 -адреноблокатора ацебуталола. Препарат ацебуталол относится к группе β 1 -адреноблокаторов, обладающих собственной внутренней симпатомиметической активностью, т.е. сочетает свойства блокатора (литика) и стимулятора (миметика) β 1 -адренорецепторов.
Механизм действия ацебуталола обусловлен особенностями его химической структуры, благодаря чему препарат, с одной стороны, блокирует β 1 -адренорецепторы миокарда, а с другой стороны, стимулирует их активность, имитируя тем самым физиологическое действие медиаторов - катехоламинов (см. Т. 1. с. 170).
Все ЛС по особенности своего действия можно разделить на две большие группы - обладающие специфическим и неспецифическим действием.
К ЛС, обладающим неспецифическим действием, относятся препараты, имеющие широкий спектр фармакологической активности и различные точки приложения эффектов. К этой группе относятся витамины, биогенные стимуляторы, антиоксиданты, адаптогены и т.д.
К ЛС, обладающим специфическим действием, относятся препараты, характеризующиеся свойствами агонистов или антагонистов соответствующих рецепторов, т.е. в основе механизма их действия лежит способность взаимодействовать со специфическими для них рецепторами.
Вместе с тем следует отметить, что фармакологический эффект ЛС, обладающих специфическим действием на какие-либо рецепторы, не всегда будет узко специализированным, например, уменьшение частоты сердечных сокращений (ЧСС) или подавление секреции желудочного сока. Суммарный фармакологический эффект многих ЛС будет зависеть от того, с каким количеством и в каких органах и тканях организма локализованы специфические для данного ЛС рецепторные образования.
Например, β-адренорецепторы находятся п сердечной мышце, стенке сосудов, бронхах, матке, жировой ткани, скелетной мускулатуре и т.д. Вследствие этого ЛС, стимулирующие β-адренорецепторы, будут в гой или иной степени вызывать увеличение силы и частоты сердечных сокращений, расширение сосудов, бронхов, понижать тонус матки, т. е. оказывать на организм системное действие.
Специфическое действие ЛС может быть селективным или избирательным и, соответственно, неселективным или неизбирательным. Селективность ЛС определяется тем, влияет ли оно на все подвиды каких-либо рецепторов или на определенный их подвид.
Например, неселективный β-адреноблокатор пропранолол блокирует как β 1 -адренорецепторы, расположенные в ткани миокарда, так и β 2 -адренорецепторы, расположенные, в частности, в ткани легких, т е. оказывает неизбирательное (неселективное) действие на оба подвида β-адренорецепторов. тогда как селективный β 1 -адреноблокатор атенолол в терапевтических дозах блокирует только β 1 -адренорецепторы миокарда, т.е. оказывает избирательное (селективное) действие на определенный подвил β-адренорецепторов.
Выяснение физиологической роли и локализации подвидов рецепторов позволяет создать высокоэффективные ЛС, избирательно действующие на разные подвиды рецепторов.
Например, ЛС, блокирующие β 1 -адренорецепторы, широко используют в клинике для лечения ишемической болезни сердца, артериальной гипертензии, а ЛС, стимулирующие β 2 -адренорецепторы, нашли свое применение для лечения бронхиальной астмы. Лекарственные средства, блокирующие Н 1 -гистаминовые рецепторы, в клинической практике преимущественно назначают дли предотвращения и/или купирования аллергических реакций, тогда как ЛС, блокирующие Н 2 -гистаминовые рецепторы, эффективны влечении язвенной болезни желудка и двенадцатиперстной кишки.
Создание ЛС, обладающих селективным действием, позволило во многом оптимизировать их клиническое применение, так как в значительной мере уменьшается их побочное действие.
В основе механизма действия ЛС, как правило, лежит их способность инициировать (запускать) сложные биохимические и/или биофизические процессы, которые в конечном итоге изменяют и/или оптимизируют функциональную активность клетки-мишени.Лекарственные средства могут реализовывать свое действие в отношении органов и/или клеток-мишеней путем: прямого химического взаимодействия; физико-химического взаимодействия на мембране клетки; действия на специализированные ферменты; действия на регуляторные гены; действия на специфические рецепторы.
Прямое химическое взаимодействие ЛС.
Этот механизм действия ЛС встречается достаточно редко и может реализоваться вне клетки, например, в просвете желудка или кишечника. Суть его заключается в том, что ЛС вступает в прямую химическую реакцию с молекулами и/или ионами, образующимися в организме в норме или при патологическом состоянии. Примером прямого химического взаимодействия может служить химическая реакция нейтрализации соляной кислоты желудка при приеме антацидных ЛС.
Физико-химическое взаимодействие ЛС на мембране клетки.
Одной из основных функций цитоплазматической мембраны является осуществление ионного обмена между цитоплазмой и внеклеточной средой. Трансмембранный ионный обмен может осуществляться в том числе и через специальные потенциалзависимые трансмембранные ионные каналы - натриевые, калиевые, кальциевые, хлорные и т.д. Некоторые лекарства, достигая клеточной мембраны, взаимодействуют с этими каналами и изменяют их функциональную активность. Так, например, в основе антиаритмического действия препарата IA класса - хинидина - лежит его способность блокировать прохождение ионов Na + через трансмембранные натриевые каналы.
Действие ЛС на специализированные ферменты.
Относительно небольшое количество ЛС реализует свой фармакологический эффект путем изменения активности некоторых специализированных клеточных ферментов. Лекарственные средства, повышающие активность клеточных ферментов, называют индукторами ферментов. Таким действием обладает, например, снотворный и противосудорожный препарат фенобарбитал, который значительно усиливает активность микросомальных ферментов печени. Биологическое значение этого эффекта фенобарбитала и близких к нему ЛС будет рассмотрено далее.
Лекарственные средства, угнетающие активность специализированных ферментов, называют ингибиторами ферментов. Так, например, антидепрессант из группы ингибиторов моноаминоксидазы (МАО) препарат пирлиндол реализует свое антидепрессивное действие путем подавления активности фермента МАО в ЦНС. Способность ингибировать активность фермента ацетилхолинэстеразы лежит в основе фармакологической активности антихолинэстеразных ЛС, например физостигмина. Известно, что в физиологических условиях ацетилхолинэстераза инактивирует (разрушает) ацетилхолин - нейромедиатор, передающий возбуждение в синапсах парасимпатической нервной системы. Физостигмин, подавляя активность ацетилхолинэстеразы, способствует накоплению в синапсах парасимпатической системы нейромедиатора ацетилхолина, в результате чего тонус парасимпатической нервной системы повышается, что на системном уровне проявляется развитием брадикардии, снижением артериального давления (АД), усилением моторики желудочно-кишечного тракта (ЖКТ), сужением зрачка и т.д. Лекарственные средства могут взаимодействовать с ферментами обратимо и необратимо. Так, например, препарат эналаприл обратимо ингибирует активность ангиотензинпревращающего фермента, что влечет за собой, в частности, понижение АД, тогда как фосфорорганические отравляющие вещества необратимо подавляют активность ацетилхолинэстеразы. Действие ЛС на регуляторные гены. В настоящее время ученые предпринимают попытки создания ЛС, реализующих свои фармакологические эффекты путем прямого воздействия на физиологическую активность регуляторных генов. Особенно перспективным это направление представляется после того, как в 2000 г. была расшифрована структура генома человека. Полагают, что избирательная нормализация функции регуляторных генов под воздействием ЛС позволит добиться успеха в лечении многих, в том числе ранее неизлечимых, болезней. Действие ЛС на рецепторы. Прежде чем перейти к особенностям взаимодействия ЛС с рецепторами, необходимо уточнить, что мы понимаем под термином «рецептор» (от лат. recipio - брать, принимать). Из курса физиологии известно, что под термином «рецептор» понимают высокоспециализированные образования, способные воспринимать, трансформировать и передавать энергию внешнего сигнала в нервную систему. Такие рецепторы называют сенсорными (от лат. sensus - чувство, ощущение, восприятие). К сенсорным рецепторам относятся рецепторы органов слуха, зрения, обоняния, вкуса, осязания и т.д. Сенсорные рецепторы этих органов относятся к так называемым экстерорецепторам. Если наличие органов чувств, реагирующих на внешние стимулы раздражения, было известно с давних времен, то наличие сенсорных рецепторов и внутри организма подвергалось сомнению вплоть до середины XIX в. Впервые о наличии такого рода рецепторов и внутри организма высказал предположение русский физиолог И.Ф. Цион, показавший в 1866 г. падение АД вследствие раздражения аорты в опыте на кролике. Это открытие дало начало для поиска и изучения рецепторов, расположенных внутри организма, а сами эти рецепторы получили название интеро рецепторов. К началу XX в. было выявлено достаточное количество сенсорных интерорецепторов и доказана их важная роль в регуляции физиологических функций организма. В 1905 г. Дж. Лэнгли (J. Langley) доказал, что при нанесении ЛС на клеточную мембрану фармакологический эффект развивается в том случае, если оно нанесено только на определенный ее участок. Причем этот участок составляет лишь небольшую часть общей площади клеточной поверхности. Это наблюдение позволило Дж. Лэнгли сделать заключение о том, что на клеточной мембране существуют специализированные рецепторные участки, взаимодействующие с ЛС. Однако приоритет в создании рецепторной теории действия ЛС принадлежит немецкому физиологу П.Эрлиху (P. Ehrlich), который в 1906 г. впервые ввел термин «рецептор» и сформулировал постулат «лекарственное вещество не действует, если не фиксируется на мембране клетки». Согласно теории П.Эрлиха, молекула ЛС имеет две функционально активные группы, одна из которых обеспечивает его фиксацию на поверхности клетки в области лекарственного рецептора, а вторая функциональная группа взаимодействует с рецептором и запускает сложную цепь биохимических реакций, обеспечивающих изменение ее (клетки) физиологической активности. Таким образом, еще в начале XX в. стало очевидно, что существует, как минимум, два класса интерорецепторов: сенсорные рецепторы, осуществляющие передачу информации о состоянии внутренних органов и тканей организма в ЦНС; клеточные рецепторы, которые взаимодействуют с ЛС, изменяющими функциональную активность клеток-мишеней. <>Сразу же следует оговориться, что в дальнейшем в тексте учебника во избежание путаницы в терминологии рецепторы для ЛС и биологически активных веществ, т. е. клеточные, или циторецепто ры, будут обозначаться термином «рецептор», тогда как сенсорные интерорецепторы будут обозначаться термином, характеризующим их функциональную активность, например, «барорецепторы», «болевые рецепторы» и т.д. Открытие П.Эрлихом на клеточной мембране рецепторов для ЛС послужило отправной точкой для развития фармакологической науки, в частности фармакодинамики, одной из основных задач которой является изучение рецепторных механизмов действия ЛС. В настоящее время выявлена структура большого числа клеточных рецепторов, особенности взаимодействия с ними тех или иных биологически активных соединений, что позволило, с одной стороны, понять механизм действия известных ЛС, а с другой стороны, явилось основой для создания новых высокоэффективных ЛС. Естественно, трудно себе представить, что в организме человека в процессе эволюции образовались рецепторы к различным синтетическим (полученным химическим путем) ЛС, тем более, что подавляющее большинство представленных на современном фармацевтическом рынке ЛС были синтезированы в последние 50 лет и менее. Доказано, что рецепторный аппарат клетки - очень древнее функционально-структурное образование. Так, a- и b-адренорецепторы (рецепторы, взаимодействие с которыми норадреналина и адреналина влияет на функциональную активность клетки) обнаружены не только в клетках животных, но и на клеточных мембранах клеток растений, например в клетках растения ниттела, где a- и b-адренорецепторы регулируют движение протоплазмы (содержимого клетки). Тогда что же представляют собой рецепторы для ЛС, открытые П.Эрлихом, и почему с ними они взаимодействуют? В настоящее время не вызывает сомнений, что так называемые лекарственные рецепторы на самом деле являются рецепторами для эндогенных (вырабатываемых в организме) биологически активных веществ, участвующих в регуляции функциональной активности внутренних органов и тканей организма. К таким биологически активным соединениям относятся вещества, выделяющиеся из нервных окончаний в момент передачи нервного сигнала, а также гормоны, витамины, аминокислоты и т.д. Для каждого эндогенного биологически активного вещества существуют строго специфичные для него рецепторы. Так, например, вырабатываемое в организме биологически активное вещество адреналин может активировать строго специфичные для него a- и b-адренорецепторы, а глюкокортикостероиды - гормоны коры надпочечников - взаимодействуют только со строго специфичными для них глюкокортикостероидными рецепторами. Синтетические ЛС, реализующие свои эффекты путем взаимодействия с рецепторным аппаратом клетки, по своей химической структуре в той или иной мере подобны эндогенным биологически активным соединениям, взаимодействующим с аналогичными рецепторами. Так, например, синтетическое вазоконстрикторное (вызывающее сужение сосудов) ЛС фенилэфрин по своей химической структуре близок к эндогенному биологически активному веществу норадреналину, поэтому так же как и норадреналин, обладает способностью стимулировать a-адренорецепторы. Иногда в связи с особенностями своего химического строения ЛС могут взаимодействовать не с самим рецептором, а с прилежащим к нему участком клеточной мембраны. Так как в данном случае ЛС взаимодействует не с самим рецептором, а с прилегающим к нему участком клеточной мембраны, говорят не о возбуждающем или блокирующем влиянии на рецептор, а об аллосте рическом (от греч. allos - другой, иной) воздействии, или эффекте. В результате может происходить изменение как структуры прилежащей к рецептору мембраны, так и отдельных компонентов самого рецептора, что может повлечь за собой изменение чувствительности рецептора к специфичному для него биологически активному веществу. В тех случаях, когда чувствительность рецептора к биологически активному веществу повышается, говорят о сенситизации (от лат. sensus - чувство) или о сенсибилизации (от лат. sensibilis - чувствительность) рецептора, а в тех случаях, когда чувствительность рецептора понижается, говорят о десенситизации рецептора. Особенность аллостерического воздействия заключается в том, что ЛС, обладающее такого рода механизмом действия, непосредственно на передачу нервного импульса не влияет, но видоизменяет ее в желаемом направлении. Например, в основе механизма действия анксиолитиков (противотревожных ЛС; синонимы: транквилизаторы), по своей химической структуре являющихся производными бензодиазепина, лежит феномен аллостерического возбуждения постсинаптических бензодиазепиновых рецепторов. Возбуждение последних в свою очередь, способствует активации тормозных постсинаптических рецепторов гамма-аминомасляной кислоты (ГАМК-рецепторов), что клинически проявляется устранением таких симптомов невротических заболеваний, как чувство беспокойства, тревоги, страха и т.д. Рецепторы, взаимодействуя с которыми, биологически активное вещество или ЛС каким-либо образом изменяет функциональное состояние клетки-мишени, называют специфическими. Помимо специфических рецепторов, выделяют так называемые неспецифические для ЛС рецепторы. В специальной медицинской литературе эти рецепторы также называют «местом потери» ЛС. Связываясь с такими рецепторами, лекарства не оказывают какого-либо биологического эффекта, а сами становятся биологически неактивными. Примером такого вида рецепторов могут служить рецепторы, расположенные на белках плазмы крови, в частности, на водорастворимых белках - альбуминах. Структура рецепторов достаточно сложна, но большинство из них представляют собой белковые макромолекулы или гликопротеины, в состав которых могут также входить ионы, липиды, нуклеиновые кислоты и т.д. Рецептор, т.е. образующая его белковая макромолекула, характеризуется определенным, специфическим для каждого рецептора пространственным расположением входящих в него химических групп. Белковая макромолекула, образующая рецептор, может быть интегрирована (погружена) в липидный бислой цитоплазматической мембраны или локализоваться внутри клетки. Основной функцией клеточного рецептора является «распознавание» химического сигнала, передающегося ему посредством эндогенного биологически активного вещества и/или ЛС и трансформация его в соответствующий биохимический и/или биофизический ответ клетки. Ранее полагали, что ЛС или эндогенные биологически активные вещества взаимодействуют с рецепторами по типу «ключ и замок», т.е. рецептор имеет такую структуру, которая позволяет ЛС находить «свой» рецептор, соединяться с ним и как бы «включать» и «выключать» его. Однако с развитием медицинской науки стало очевидно, что это не совсем так. В настоящее время уже достаточно хорошо изучены особенности молекулярных процессов превращения внеклеточных сигналов во внутриклеточные, регулирующие функцию клетки, т.е. механизмы, в результате которых реализуется эффект взаимодействия эндогенных биологически активных веществ или ЛС с рецепторами. При взаимодействии с рецептором эндогенного биологически активного вещества и/или подобно ему действующего ЛС происходит конформация - пространственное изменение формы - белковой макромолекулы, что является пусковым механизмом для различных внутриклеточных процессов, определяющих реакцию клетки-мишени на медиатор и/или ЛС. Например, активацияb 2 -адренорецепторов гладких мышц бронхов под влиянием b 2 -адре-ностимулятора фенотерол влечет за собой повышение активности фермента аденилатциклазы, который способствует накоплению в клетке циклического аденозинмонофосфата (цАМФ) и, как следствие этого, расслаблению клетки. В общем биологическом плане клеточные рецепторы можно рассматривать как строго специализированные «органы чувств» клеток, посредством которых они воспринимают «информацию», исходящую, например, из ЦНС и/или эндокринной системы. Несмотря на столь важную роль рецепторного аппарата, рецепторы занимают лишь незначительную часть мембраны клеток. Например, М-холинорецепторный аппарат клетки занимает не более 1/6 000 площади ее поверхности. Изучение особенностей взаимодействия ЛС с рецептором, с одной стороны, позволяет понять основу молекулярного механизма его действия, а с другой стороны, позволяет получить информацию о том, какие изменения следует провести в структуре ЛС, чтобы усилить его способность взаимодействовать с данным рецептором, т. е. позволяет вести целенаправленный синтез новых высокоэффективных ЛС. В физиологических условиях разные клеточные рецепторы функционируют не самостоятельно, а находятся в постоянном взаимодействии друг с другом, регулируя тем самым специфическую активность клетки. Так, например, активация b-адренорецепторов сердечной клетки эндогенным норадреналином вызывает, в частности, учащение числа сердечных сокращений, а активация М-холинорецепторов сердечных клеток эндогенным ацетилхолином, напротив, вызывает урежение числа сердечных сокращений. Большой вклад в понимание рецепторных механизмов действия ЛС внесло открытие пре- и постсинаптических рецепторов. Си напс (от греч. synopsis - соединение, связь) представляет собой специализированную зону контакта между нервными клетками или другими возбудимыми структурами организма, обеспечивающую передачу приходящей информации и сохранение ее информационной значимости. Изучение структуры и функциональной роли синапсов было начато в конце XIX в. после того, как испанский гистолог С. Рамон-и-Кахаль (S.Ramon у Cajal) высказал предположение о наличии в ЦНС специализированной передающей системы. Свое название синапсы получили в 1897 г., когда английский физиолог Ч.Шеррингтон (Ch. Sherrington) предложил этот термин для обозначения зоны контакта между нервными клетками. В настоящее время выделяют три вида синапсов: 1) «электрические» синапсы, в которых передача информации осуществляется путем перехода электрического сигнала с пре- на постсинаптическую мембрану. Такой вид синапсов носит название эфапс (от греч. ephapsis - плотный контакт); 2) «химические» синапсы, в которых передача информации осуществляется посредством специальных биологически активных веществ - нейромедиаторов (от греч. neuron - нерв и лат. mediator - посредник; синонимы: медиатор); 3) «смешанные» синапсы, в которых передача информации осуществляется и химическим, и электрическим путем. Фармакологические эффекты подавляющего большинства ЛС, влияющих на функции синапсов, реализуются путем их воздействия на тот или иной этап передачи сигнала в химических синапсах, т.е. в синапсах второго вида. Как правило, химические синапсы классифицируют по нейромедиаторам, осуществляющим в них передачу нервного импульса, следующим образом: синапсы, в которых в качестве медиатора выступает ацетилхолин, называют холинергическими; синапсы, в которых в качестве медиатора выступают адреналин и норадреналин, называют адренергическими; синапсы, в которых в качестве медиатора выступают АТФ и аденозин, называют пуринергическими; синапсы, в которых в качестве медиатора выступает гамма-аминомасляная кислота, называются ГАМК-ергические и т.д. Структура синапса в настоящее время достаточно хорошо изучена. Синапс состоит из пресинаптического отростка нервной клетки (окончания аксона) и воспринимающего «сигнал» аппарата, расположенного на мембране эффекторной («исполнительной») клетки.
Фармакодинамика
Изучает механизм действия лекарственных средств, а также их биохимические и физиологические эффекты. В ее задачи входит описание химических и физических взаимодействий между препаратом и клеткой-мишенью, а также полного спектра и выраженности его фармакологических эффектов. Знание фармакодинамических закономерностей позволяет правильно подобрать медикаментозное лечение. Фармакодинамические исследования обеспечивают более глубокое понимание регуляции биохимических и физиологических процессов в организме (Катцунг Б.Г., 1998; Лоуренс Д.Р. и соавт., 2002).
Действие большинства лекарственных средств опосредовано их связыванием с макромолекулами организма. Изменение функционального состояния этих макромолекул, в свою очередь, запускает цепь биохимических и физиологических реакций, которые преобразуются в фармакологический эффект. Макромолекулы, с которыми взаимодействуют химические вещества, называются рецепторами. Таким образом, любые функционально активные макромолекулы могут служить рецепторами для лекарственных средств. Из этого утверждения вытекает несколько важных следствий. Во-первых, с помощью лекарственных средств можно изменять скорость любого физиологического процесса в организме. Во-вторых, лекарственные средства лишь изменяют естественные физиологические функции клетки, не придавая ей новых свойств.
Рецепторы
Большинство рецепторов представляют собой белки. Это рецепторы гормонов, факторов роста, медиаторов, белки, участвующие в важнейших метаболических и регуляторных реакциях (дигидрофолатредуктаза, ацетилхолинэстераза), транспортные белки (Nа + , K + -АТФаза), структурные белки (тубулин). В роли рецепторов могут выступать и клеточные компоненты иной химической природы, например нуклеиновые кислоты, с которыми взаимодействуют противоопухолевые средства.
Фармакологическое значение имеют рецепторы эндогенных регуляторных факторов — гормонов, медиаторов и т.д. Эти рецепторы служат мишенями для многих лекарственных средств, обычно действующих избирательно благодаря высокой специфичности рецепторов по отношению к эндогенным лигандам. Лекарственные средства, которые при связывании с рецептором воспроизводят физиологический эффект эндогенного лиганда, называются аганистами, или стимуляторами. Препараты, которые не вызывают такого эффекта, но препятствуют связыванию эндогенных лигандов, называют антагонистами, или блокаторами. Вещества, эффект которых менее выражен, чем эффект агонистов, называют частичными агонистами. Препараты, стабилизирующие рецептор в неактивированой конформации, относят к обратным агонистам.
Структурно-функциональная зависимость
Химическая структура препарата достаточно жестко определяет его сродство к рецепторам и внутреннюю активность. Незначительное изменение химического строения может существенно отразится на фармакологических свойствах.
На этом в значительной мере основан синтез новых лекарственных средств. Поскольку химическая модификация не обязательно отражается на всех фармакологических свойствах в равной степени, можно улучшить эффективность и безопасность препарата, повысить его избирательность, усовершенствовать фармакокинетические характеристики. Например, многие применяемые в клинике антагонисты гормонов и медиаторов синтезированы путем химической модификации эндогенных веществ.
Точки приложения лекарственных средств
Поскольку действие лекарственных средств опосредовано рецепторами, точка приложения препарата определяется не только особенностями его распределения, но и локализацией рецепторов, а фармакологические эффекты зависят от функциональной значимости этих рецепторов. Фармакологические эффекты лекарственных средств, чьи рецепторы распространены во многих органах и тканях, разнообразны. Если эти рецепторы выполняют жизненно важную для клеток функцию, применять препарат в терапевтических целях не только трудно, но и небезопасно. Тем не менее подобные препараты могут иметь большое клиническое значение. Так, сердечные гликозиды, широко применяемые при СН, изменяют транспорт ионов через клеточную мембрану, от которого зависит жизнедеятельность клетки. Они обладают узким терапевтическим диапазоном и очень токсичны. Другим примером могут служить противоопухолевые средства. Если же рецепторы, с которыми взаимодействует препарат, имеются лишь на нескольких типах дифференцированных клеток, его действие более избирательно. У этих лекарственных средств побочных реакций может быть меньше, но все же эти средства могут оказаться токсичными, если их рецепторы выполняют жизненно важную функцию. Подобным образом действуют некоторые биологические яды (ботулотоксин и др.). Кроме того, даже если прямой фармакологический эффект избирателен, то его последствия могут оказаться более многообразными.
Рецепторы эндогенных регуляторных факторов
Термином рецептор обозначают любой макромолекулярный компонент клетки, с которым связывается лекарственное средство. Один из наиболее важных рецепторов лекарственных средств - клеточные белки, которые служат рецепторами для эндогенных регуляторных факторов - гормонов, факторов роста, медиаторов. Связываясь с эндогенным лигандом, рецепторы передают поступающий от него сигнал внутрь клетки-мишени.
От рецептора сигнал поступает к клеточным мишеням (эффекторным белкам) непосредственно или через промежуточные сигнальные молекулы - белки-преобразователи. Рецептор, белкипреобразователи и эффекторные белки образуют рецепторно-эффекторную систему. Ближайший в цепи передачи сигнала эффекторный белок часто представляет собой не конечный эффектор (непосредственно влияющий на клеточные функции), а фермент или транспортный белок, участвующий в образовании, транспорте либо инактивации второго посредника - иона или небольшой молекулы. Второй посредник, в свою очередь, переносит информацию к разнообразным внутриклеточным мишеням, обеспечивая их одновременную реакцию на сигнал от одного рецептора.
Рецепторы, белки-преобразователи и эффекторные белки не только передают информацию. Они также координируют сигналы, поступающие от разных лигандов, с одной стороны, и все эти сигналы с метаболическими процессами в клетке - с другой.
Действуя как катализаторы, рецепторы усиливают биологический сигнал. Благодаря этому важному свойству они служат прекрасными мишенями для лекарственных средств. Впрочем, усилителями сигнала служат не только рецепторы с ферментативной активностью, а все известные рецепторы. Действительно, при связывании одной молекулы лиганда с рецептором, сопряженным с ионным каналом, через последний проходит множество ионов. То же самое справедливо и в отношении рецепторов стероидных гормонов: одна молекула гормона запускает транскрипцию многих копий мРНК, на основе которых синтезируются многочисленные молекулы белка.
В зависимости от структуры и механизма действия рецепторы биологически активных веществ делят на несколько классов. Количество этих классов небольшое.
Рецепторы с ферментативной активностью
Самая большая группа рецепторов, обладающих ферментативной активностью, - это мембранные рецепторы с собственной протеинкиназной активностью. Они фосфорилируют разнообразные эффекторные белки, расположенные с внутренней стороны клеточной мембраны. В результате изменяется функция этих белков или их взаимодействие с другими белками.
Существует еще один класс рецепторов с протеинкиназной активностью - это рецепторы, сопряженные с протеинкиназами. Они лишены внутриклеточного каталитического домена, но при взаимодействии с агонистом связывают или активируют на внутренней поверхности мембраны внутриклеточные протеинкиназы. Таковы рецепторы нейротрофических факторов и состоящие из нескольких субъединиц антигенраспознающие рецепторы Т- и В-лимфоцитов. Последние взаимодействуют также с фосфотирозинфосфатами. Функция других рецепторов, не имеющих внутриклеточного эффекторного домена, возможно, опосредована какими-то другими эффекторными белками.
Сходную структуру имеют и другие рецепторы с собственной ферментативной активностью. К ним относятся, например, рецепторы с собственной фосфотирозинфосфатазной активностью: их внеклеточный домен похож по аминокислотной последовательности на молекулы адгезии. Для многих рецепторов с собственной фосфотирозинфосфатазной активностью эндогенные лиганды не известны. Тем не менее, по данным генетических и биохимических исследований, проведенных на разных типах клеток, ферментативная активность этих рецепторов играет важную роль. Внутриклеточный домен рецепторов предсердного натрийуретического гормона, других НУП, а также рецепторов гуанилина обладает собственной гуанилатциклазной активностью и синтезирует цГМФ, выступающий в роли второго посредника. Возможно, существуют и другие рецепторы с собственной ферментативной активностью.
Рецепторы, сопряженные с ионными каналами
Рецепторы некоторых медиаторов непосредственно связаны с ионными каналами, при взаимодействии с лигандом избирательно пропускающими через клеточную мембрану те или иные ионы (хемочувствительные каналы, ионотропные рецепторы-каналы, ионотропные рецепторы).
Рецепторы, сопряженные с G-белками
Это довольно большой класс рецепторов, которые взаимодействуют с эффекторами через G-белки (белки, использующие замену гуанин дифосфата (ГДФ) на гуанин трифосфат (ГТФ). К нему относятся рецепторы многих биогенных аминов, липидных сигнальных молекул (в частности эйкозаноидов), разнообразных пептидных и белковых лигандов. В качестве эффекторов выступают ферменты (аденилатциклаза, фосфолипаза С) и калиевые и кальциевые мембранные каналы. Большое количество и важная физиологическая роль рецепторов, сопряженных с G-белками, делает их прекрасными мишенями для лекарственных средств: на эти рецепторы действует примерно половина всех назначаемых врачами препаратов (исключая антибиотики).
Клетка может нести на своей поверхности до 20 рецепторов, каждый из которых избирательно взаимодействует с одним или несколькими типами G-белков (у разных типов α-субъединицы различаются). α-Субъединица способна взаимодействовать с одним или несколькими эффекторными белками, что позволяет согласовывать сигналы от рецепторов разных лигандов с помощью одного G-белка. С другой стороны, один рецептор может запускать несколько механизмов внутриклеточной передачи сигнала, активируя несколько типов G-белков, и воздействовать на разные эффекторные белки через одну и ту же α-субъединицу. Столь сложная система дивергенции и конвергенции сигналов обеспечивает гибкую регуляцию клеточных функций (Ross, 1992).
Внутриклеточные рецепторы
Рецепторы стероидных и тиреоидных гормонов, кальцитриола и ретиноидов представляют собой растворимые внутриклеточные ДНК-связывающие белки, регулирующие транскрипцию определенных генов (Mangelsdorf et al., 1994). Эти рецепторы принадлежат к суперсемейству лигандчувствительных регуляторов транскрипции. Функция факторов транскрипции регулируется посредством фосфорилирования, взаимодействия с клеточными белками, метаболитами и другими регуляторными компонентами клетки.
Системы вторых посредников
цАМФ.В интеграции внешних сигналов участвуют также системы вторых посредников. Хотя рецепторов и белковых сигнальных молекул известно гораздо больше, чем вторых посредников, последние задействованы во множестве путей внутри клеточной передачи сигнала. К наиболее изученным вторым посредникам относятся цАМФ, цГМФ, Са 2+ , ИФ 3 (инозитол трифосфат), ДАГ (диацилглицерол), NО. Эта группа разнородных соединений постоянно пополняется. Вторые посредники взаимодействуют напрямую (изменяя метаболизм друг друга) или косвенно (воздействуя на одни и те же внутриклеточные мишени). Функцию вторых посредников, а также регуляцию их образования (или высвобождения), расщепления и выведения из клетки удобно рассматривать на примере цАМФ. Этот второй посредник синтезируется под действием аденилатциктазы при активации многих рецепторов, сопряженных с G-белками. G s -белок активирует аденилатциклазу, G i -белок - ингибирует.
Существует не менее 10 тканеспецифичных изоформ аденилатциктазы, различающихся по механизмам регуляции активности.
Как правило, цАМФ активирует протеинкиназы А (цАМФ-зависимые протеинкиназы) - небольшую группу родственных белков. Эти протеинкиназы в свою очередь фосфорилируют не только конечные внутриклеточные мишени (ферменты, транспортные белки), но и другие протеинкиназы и прочие регуляторные белки. К последним относятся, например, факторы транскрипции. Они отвечают за опосредованную цАМФ регуляцию транскрипции генов, обеспечивая отсроченную клеточную реакцию на сигнал. Помимо активации протеинкиназ цАМФ воздействует непосредственно на мембранные катионные каналы, играющие важную роль, в частности, в функционировании нейронов. Таким образом, сигнал от цАМФ вызывает цепь биохимических изменений в клетке-мишени.
Кальций. Еще один хорошо изученный второй по средник - внутриклеточный Са 2+ . Ионы Са 2+ по ступают в цитоплазму различными путями: по мембранным каналам (зависимый от G-белков, потенциалзависимый, регулируемый К + либо са-мим Са 2+), а также по каналам, расположенным в особых участках эндоплазматического ретикулума и открывающимся под действием ИФ 3 , а в скелетных мышцах - в результате деполяризации мембраны. Удаление кальция из цито плазмы происходит двумя путями: он по глощается эндоплазматическим ретикулумом или выводится из клетки. Са 2+ передает сигналы гораздо большему количеству белков, чем цАМФ, - фер-ментам, участвующим в клеточном метаболизме, протеинкиназам, кальцийсвязывающим белкам. Последние взаимодействуют с другими конечными и промежуточными эффекторами.
Регуляция рецепторов
Рецепторы не только управляют физиологическими и биохимическими функциями, но и сами служат объектами регуляции. Эта регуляция осуществляется на уровне синтеза и распада их макромолекул, посредством образования ковалентной связи с другими молекулами, взаимодействия с регуляторными белками, перемещения рецептора. Регуляции подвержены также белки-преобразователи и эффекторные белки. Регулирующие сигналы могут поступать от путей внутриклеточной передачи, активируемых при стимуляции самого рецептора (по механизму обратной связи), а также от других рецепторов (напрямую или опосредованно).
Длительная стимуляция рецепторов лекарственных средств обычно приводит к снижению реакции на него - в той же концентрации препарат вызывает менее выраженный эффект. Это явление, называемое десенситизацией, рефрактерностью, привыканием, играет важную роль в клинической практике: например, при длительном применении β-адреномиметиков для лечения пациентов с БА выраженность реакции на эти препараты уменьшается.
Гомологическая десенситизация касается только стимулированных рецепторов и специфична по отношению к лиганду. При гетерологичной десенситизации уменьшается выраженность реакции на другие лиганды, рецепторы которых действуют через тот же путь внутриклеточной передачи сигнала. В первом случае отрицательная обратная связь обеспечивается воздействием на сам рецептор (фосфорилирование, протеолиз, снижение синтеза), во втором случае помимо рецептора она может затрагивать и другие белки, участвующие во внутриклеточной передаче сигнала.
Напротив, если в течение продолжительноговремени рецепторы не стимулируются, их чувствительность к агонистам возрастает (например, при продолжительном лечении β-адреноблокатором пропронололом повышается чувствительность β-адренорецепторов к β-адреностимуляторам).
Заболевания, обусловленные нарушениями функции рецепторов
Помимо индивидуальных различий в чувствительности к лекарственным средствам существуют заболевания, обусловленные нарушением функции тех или иных компонентов механизма внутриклеточной передачи сигнала от рецептора к эффектору. При выпадении функции высокоспециализированых рецепторов фенотипические проявления заболевания могут быть ограниченными (например, при тестикулярной феминизации, связанной с генетическим обусловленным отсутствием или структурными дефектами андрогенных рецепторов). Если нарушен более универсальный механизм внутри клеточной передачи сигнала, симптомы болезни разнообразнее, как, например, при миастении и некоторых формах инсулинорезистентного сахарного диабета, вызванных соответственно аутоимунными нарушениями функции N-холинорецепторов и рецепторов инсулина. Дефекты какого-либо компонента, участвующего в передаче сигнала от многих рецепторов, приводят ко множественным эндокринным нарушениям. Примером может служить гетерозиготная форма дефицита белка G s , активирующего аденилатциктазу во всех клетках (Spiegel and Weinstein, 1995). Гомозиготная форма дефицита этого белка, вероятно, приводит к смерти.
Нарушения в структуре или локализации рецепторов могут проявиться ослабленной или усиленной реакцией на лекарственное средство, а также другими нежелательными эффектами.
Мутации, кодирующие рецепторы генов, способны изменять как реакцию на однократное применение препарата, так и эффективность длительного лечения. Например, дефект β-адренорецепторов, отвечающих за расслабление гладких мышц бронхов и регулирующих сопротивление дыхательных путей, усугубляет снижение чувствительности этих рецепторов к β-адреностимуляторам при длительном лечении пациентов с БА. По мере выявления мутаций, ответственных за нарушение функции рецепторов, и клонирования соответствующих генов появится возможность разработать методы лечения таких заболеваний.
Классификация рецепторов
Традиционно рецепторы лекарственных средств выявляли и классифицировали на основании эффектов и относительной активности действующих на эти рецепторы избирательных агонистов (стимуляторов) и антагонистов (блокаторов). Например, эффекты ацетилхолина, которые воспроизводятся при взаимодействии с холинорецепторами алкалоида мускарина и блокируются атропином, называют мускариновыми эффектами, а эффекты, которые воспроизводятся при взаимодействии с холинорецепторами никотина, - никотиновыми эффектами. Рецепторы, которые опосредуют действие мускарина и никотина, получили название соответственно М- и N-холинорецепторов. Хотя подобная классификация обычно не отражает механизм действия лекарственных средств, она удобна для систематизации их эффектов. Действительно, утверждение, что лекарственное средство стимулирует рецепторы определенного типа, одновременно определяет спектр эффектов данного препарата и вещества, усиливающие или ослабляющие эти эффекты. Однако правомочность таких утверждений может меняться с выявлением новых типов и подтипов рецепторов, открытием дополнительных механизмов действия лекарственных средств или ранее неизвестных побочных эффектов.
Подтипы рецепторов
С появлением все более разнообразных высокоизбирательных лекарственных средств стало ясно, что ранее известные типы рецепторов делятся на множество подтипов. Существенным подспорьем в изучении новых подтипов рецепторов стали методы молекулярного клонирования, а получение рекомбинантных рецепторов облегчило создание избирательно действующих на эти рецепторы лекарственных средств. Различные, но родственные подтипы рецепторов часто (хотя и не всегда) взаимодействуют с разными агонистами и антагонистами. Рецепторы, для которых избирательные агонисты и антагонисты не выявлены, обычно относятся не к отдельному подтипу, а к изоформам одного и того же рецептора.Отдельные подтипы могут различаться и по механизмам внутриклеточной передачи сигнала. М 1 - и М 3 -холинорецепторы, например, действуют через белок G q , который активирует фосфолипазу С опосредовано вызывает выброс Са 2+ из внутриклеточных депо, а М 2 - и М 4 -холинорецепторы - через белок G i , который ингибирует аденилатциклазу. Вместе с тем деление рецепторов на типы и подтипы зачастую определяется не механизмом действия, а случайным выбором или базируется на устоявшихся представлениях. Так, α 1 -, α 2 - и β- адренорецепторы различаются по реакции на лекарственные средства и по механизму передачи сигнала (активируют соответственно белки G i , G q и G s), хотя α- и β-адренорецепторы относятся к разным типам, а α 1 - и α 2 -адренорецепторы - к разным подтипам внутри одного типа. Изоформы α 1 -адренорецепторов - α 1А, α 1В и α 1D мало отличаются по своим биохимическим свойствам; тоже самое характерно и для изоформразных под-типов β-адренорецепторов (β 1 , β 2 и β 3).
Различия между подтипами рецепторов используют для создания высокоизбирательных лекарственных средств, например препаратов, оказывающих разное действие на одну и ту же ткань благодаря связыванию с подтипами рецепторов, различающихся механизмами внутриклеточной передачи сигнала. Кроме того, лекарственные средства могут избирательно воздействовать на определенные клетки или ткани, экспрессирующие рецепторы того или иного подтипа. Чем больше избирательность лекарственных средств (по отношению к определенной ткани или по отношению к определенному эффекту), тем более благоприятно соотношение его пользы и нежелательных эффектов.
С помощью молекулярно-генетических методов открыты не только разные изоформы рецепторов, но и гены, кодирующие новые, ранее не известные рецепторы. Многие из этих рецепторов уже отнесены к тому или иному известному классу, а их функция изучена с помощью соответствующих лигандов. Однако для некоторых рецепторов лиганды до сих пор не найдены.
Открытие множества изоформ одного и того же рецептора, кодируемых разными генами (особенно если изоформы не различаются по механизмам внутриклеточной передачи сигнала и взаимодействуют с одними и теми же эндоген-ными лигандами) позволяет независимо регулировать экспрессию рецепторов в разных клетках в соответствии с потребностями организма в разные возрастные периоды.
Действие лекарственных средств, не опосредованное рецепторами
Не все лекарственные средства действуют через макромолекулярные структуры - рецепторы. Некоторые препараты взаимодействуют с небольшими молекулами или ионами, присутствующими в организме в норме либо при том или ином патологическом состоянии. Так, антациды нейтрализуют соляную кислоту в желудке. Месна (лекарственное средство, которое быстро выделяется почками и нейтрализует свободные радикалы) связывается с активными метаболитами некоторых противоопухолевых средств, уменьшая выраженность побочных реакций со стороны мочевых путей. Ряд биологически малоактивных веществ (например маннитол) можно вводить в количествах, достаточных для повышения осмолярности биологических жидкостей, и таким образом менять распределение внеклеточной и внутриклеточной жидкости. С помощью этих веществ можно усилить диурез, увеличить ОЦК, устранить отек головного мозга. Кроме того, их применяют в качестве слабительных.
Некоторые лекарственные средства могут встраиваться в компоненты клетки и изменять их функции благодаря структурному сходству с входящими в состав этих компонентов веществ. Например, аналоги пуринов и пиримидинов встраиваются в нуклеиновые кислоты и используются в качестве противовирусных и противоопухолевых средств.
А.П. Викторов "Клиническая фармакология"
Фармакодинамика
Изучает механизм действия лекарственных средств, а также их биохимические и физиологические эффекты. В ее задачи входит описание химических и физических взаимодействий между препаратом и клеткой-мишенью, а также полного спектра и выраженности его фармакологических эффектов. Знание фармакодинамических закономерностей позволяет правильно подобрать медикаментозное лечение. Фармакодинамические исследования обеспечивают более глубокое понимание регуляции биохимических и физиологических процессов в организме (Катцунг Б.Г., 1998; Лоуренс Д.Р. и соавт., 2002).
Действие большинства лекарственных средств опосредовано их связыванием с макромолекулами организма. Изменение функционального состояния этих макромолекул, в свою очередь, запускает цепь биохимических и физиологических реакций, которые преобразуются в фармакологический эффект. Макромолекулы, с которыми взаимодействуют химические вещества, называются рецепторами. Таким образом, любые функционально активные макромолекулы могут служить рецепторами для лекарственных средств. Из этого утверждения вытекает несколько важных следствий. Во-первых, с помощью лекарственных средств можно изменять скорость любого физиологического процесса в организме. Во-вторых, лекарственные средства лишь изменяют естественные физиологические функции клетки, не придавая ей новых свойств.
Рецепторы
Большинство рецепторов представляют собой белки. Это рецепторы гормонов, факторов роста, медиаторов, белки, участвующие в важнейших метаболических и регуляторных реакциях (дигидрофолатредуктаза, ацетилхолинэстераза), транспортные белки (Nа + , K + -АТФаза), структурные белки (тубулин). В роли рецепторов могут выступать и клеточные компоненты иной химической природы, например нуклеиновые кислоты, с которыми взаимодействуют противоопухолевые средства.
Фармакологическое значение имеют рецепторы эндогенных регуляторных факторов — гормонов, медиаторов и т.д. Эти рецепторы служат мишенями для многих лекарственных средств, обычно действующих избирательно благодаря высокой специфичности рецепторов по отношению к эндогенным лигандам. Лекарственные средства, которые при связывании с рецептором воспроизводят физиологический эффект эндогенного лиганда, называются аганистами, или стимуляторами. Препараты, которые не вызывают такого эффекта, но препятствуют связыванию эндогенных лигандов, называют антагонистами, или блокаторами. Вещества, эффект которых менее выражен, чем эффект агонистов, называют частичными агонистами. Препараты, стабилизирующие рецептор в неактивированой конформации, относят к обратным агонистам.
Структурно-функциональная зависимость
Химическая структура препарата достаточно жестко определяет его сродство к рецепторам и внутреннюю активность. Незначительное изменение химического строения может существенно отразится на фармакологических свойствах.
На этом в значительной мере основан синтез новых лекарственных средств. Поскольку химическая модификация не обязательно отражается на всех фармакологических свойствах в равной степени, можно улучшить эффективность и безопасность препарата, повысить его избирательность, усовершенствовать фармакокинетические характеристики. Например, многие применяемые в клинике антагонисты гормонов и медиаторов синтезированы путем химической модификации эндогенных веществ.
Точки приложения лекарственных средств
Поскольку действие лекарственных средств опосредовано рецепторами, точка приложения препарата определяется не только особенностями его распределения, но и локализацией рецепторов, а фармакологические эффекты зависят от функциональной значимости этих рецепторов. Фармакологические эффекты лекарственных средств, чьи рецепторы распространены во многих органах и тканях, разнообразны. Если эти рецепторы выполняют жизненно важную для клеток функцию, применять препарат в терапевтических целях не только трудно, но и небезопасно. Тем не менее подобные препараты могут иметь большое клиническое значение. Так, сердечные гликозиды, широко применяемые при СН, изменяют транспорт ионов через клеточную мембрану, от которого зависит жизнедеятельность клетки. Они обладают узким терапевтическим диапазоном и очень токсичны. Другим примером могут служить противоопухолевые средства. Если же рецепторы, с которыми взаимодействует препарат, имеются лишь на нескольких типах дифференцированных клеток, его действие более избирательно. У этих лекарственных средств побочных реакций может быть меньше, но все же эти средства могут оказаться токсичными, если их рецепторы выполняют жизненно важную функцию. Подобным образом действуют некоторые биологические яды (ботулотоксин и др.). Кроме того, даже если прямой фармакологический эффект избирателен, то его последствия могут оказаться более многообразными.
Рецепторы эндогенных регуляторных факторов
Термином рецептор обозначают любой макромолекулярный компонент клетки, с которым связывается лекарственное средство. Один из наиболее важных рецепторов лекарственных средств - клеточные белки, которые служат рецепторами для эндогенных регуляторных факторов - гормонов, факторов роста, медиаторов. Связываясь с эндогенным лигандом, рецепторы передают поступающий от него сигнал внутрь клетки-мишени.
От рецептора сигнал поступает к клеточным мишеням (эффекторным белкам) непосредственно или через промежуточные сигнальные молекулы - белки-преобразователи. Рецептор, белкипреобразователи и эффекторные белки образуют рецепторно-эффекторную систему. Ближайший в цепи передачи сигнала эффекторный белок часто представляет собой не конечный эффектор (непосредственно влияющий на клеточные функции), а фермент или транспортный белок, участвующий в образовании, транспорте либо инактивации второго посредника - иона или небольшой молекулы. Второй посредник, в свою очередь, переносит информацию к разнообразным внутриклеточным мишеням, обеспечивая их одновременную реакцию на сигнал от одного рецептора.
Рецепторы, белки-преобразователи и эффекторные белки не только передают информацию. Они также координируют сигналы, поступающие от разных лигандов, с одной стороны, и все эти сигналы с метаболическими процессами в клетке - с другой.
Действуя как катализаторы, рецепторы усиливают биологический сигнал. Благодаря этому важному свойству они служат прекрасными мишенями для лекарственных средств. Впрочем, усилителями сигнала служат не только рецепторы с ферментативной активностью, а все известные рецепторы. Действительно, при связывании одной молекулы лиганда с рецептором, сопряженным с ионным каналом, через последний проходит множество ионов. То же самое справедливо и в отношении рецепторов стероидных гормонов: одна молекула гормона запускает транскрипцию многих копий мРНК, на основе которых синтезируются многочисленные молекулы белка.
В зависимости от структуры и механизма действия рецепторы биологически активных веществ делят на несколько классов. Количество этих классов небольшое.
Рецепторы с ферментативной активностью
Самая большая группа рецепторов, обладающих ферментативной активностью, - это мембранные рецепторы с собственной протеинкиназной активностью. Они фосфорилируют разнообразные эффекторные белки, расположенные с внутренней стороны клеточной мембраны. В результате изменяется функция этих белков или их взаимодействие с другими белками.
Существует еще один класс рецепторов с протеинкиназной активностью - это рецепторы, сопряженные с протеинкиназами. Они лишены внутриклеточного каталитического домена, но при взаимодействии с агонистом связывают или активируют на внутренней поверхности мембраны внутриклеточные протеинкиназы. Таковы рецепторы нейротрофических факторов и состоящие из нескольких субъединиц антигенраспознающие рецепторы Т- и В-лимфоцитов. Последние взаимодействуют также с фосфотирозинфосфатами. Функция других рецепторов, не имеющих внутриклеточного эффекторного домена, возможно, опосредована какими-то другими эффекторными белками.
Сходную структуру имеют и другие рецепторы с собственной ферментативной активностью. К ним относятся, например, рецепторы с собственной фосфотирозинфосфатазной активностью: их внеклеточный домен похож по аминокислотной последовательности на молекулы адгезии. Для многих рецепторов с собственной фосфотирозинфосфатазной активностью эндогенные лиганды не известны. Тем не менее, по данным генетических и биохимических исследований, проведенных на разных типах клеток, ферментативная активность этих рецепторов играет важную роль. Внутриклеточный домен рецепторов предсердного натрийуретического гормона, других НУП, а также рецепторов гуанилина обладает собственной гуанилатциклазной активностью и синтезирует цГМФ, выступающий в роли второго посредника. Возможно, существуют и другие рецепторы с собственной ферментативной активностью.
Рецепторы, сопряженные с ионными каналами
Рецепторы некоторых медиаторов непосредственно связаны с ионными каналами, при взаимодействии с лигандом избирательно пропускающими через клеточную мембрану те или иные ионы (хемочувствительные каналы, ионотропные рецепторы-каналы, ионотропные рецепторы).
Рецепторы, сопряженные с G-белками
Это довольно большой класс рецепторов, которые взаимодействуют с эффекторами через G-белки (белки, использующие замену гуанин дифосфата (ГДФ) на гуанин трифосфат (ГТФ). К нему относятся рецепторы многих биогенных аминов, липидных сигнальных молекул (в частности эйкозаноидов), разнообразных пептидных и белковых лигандов. В качестве эффекторов выступают ферменты (аденилатциклаза, фосфолипаза С) и калиевые и кальциевые мембранные каналы. Большое количество и важная физиологическая роль рецепторов, сопряженных с G-белками, делает их прекрасными мишенями для лекарственных средств: на эти рецепторы действует примерно половина всех назначаемых врачами препаратов (исключая антибиотики).
Клетка может нести на своей поверхности до 20 рецепторов, каждый из которых избирательно взаимодействует с одним или несколькими типами G-белков (у разных типов α-субъединицы различаются). α-Субъединица способна взаимодействовать с одним или несколькими эффекторными белками, что позволяет согласовывать сигналы от рецепторов разных лигандов с помощью одного G-белка. С другой стороны, один рецептор может запускать несколько механизмов внутриклеточной передачи сигнала, активируя несколько типов G-белков, и воздействовать на разные эффекторные белки через одну и ту же α-субъединицу. Столь сложная система дивергенции и конвергенции сигналов обеспечивает гибкую регуляцию клеточных функций (Ross, 1992).
Внутриклеточные рецепторы
Рецепторы стероидных и тиреоидных гормонов, кальцитриола и ретиноидов представляют собой растворимые внутриклеточные ДНК-связывающие белки, регулирующие транскрипцию определенных генов (Mangelsdorf et al., 1994). Эти рецепторы принадлежат к суперсемейству лигандчувствительных регуляторов транскрипции. Функция факторов транскрипции регулируется посредством фосфорилирования, взаимодействия с клеточными белками, метаболитами и другими регуляторными компонентами клетки.
Системы вторых посредников
цАМФ.В интеграции внешних сигналов участвуют также системы вторых посредников. Хотя рецепторов и белковых сигнальных молекул известно гораздо больше, чем вторых посредников, последние задействованы во множестве путей внутри клеточной передачи сигнала. К наиболее изученным вторым посредникам относятся цАМФ, цГМФ, Са 2+ , ИФ 3 (инозитол трифосфат), ДАГ (диацилглицерол), NО. Эта группа разнородных соединений постоянно пополняется. Вторые посредники взаимодействуют напрямую (изменяя метаболизм друг друга) или косвенно (воздействуя на одни и те же внутриклеточные мишени). Функцию вторых посредников, а также регуляцию их образования (или высвобождения), расщепления и выведения из клетки удобно рассматривать на примере цАМФ. Этот второй посредник синтезируется под действием аденилатциктазы при активации многих рецепторов, сопряженных с G-белками. G s -белок активирует аденилатциклазу, G i -белок - ингибирует.
Существует не менее 10 тканеспецифичных изоформ аденилатциктазы, различающихся по механизмам регуляции активности.
Как правило, цАМФ активирует протеинкиназы А (цАМФ-зависимые протеинкиназы) - небольшую группу родственных белков. Эти протеинкиназы в свою очередь фосфорилируют не только конечные внутриклеточные мишени (ферменты, транспортные белки), но и другие протеинкиназы и прочие регуляторные белки. К последним относятся, например, факторы транскрипции. Они отвечают за опосредованную цАМФ регуляцию транскрипции генов, обеспечивая отсроченную клеточную реакцию на сигнал. Помимо активации протеинкиназ цАМФ воздействует непосредственно на мембранные катионные каналы, играющие важную роль, в частности, в функционировании нейронов. Таким образом, сигнал от цАМФ вызывает цепь биохимических изменений в клетке-мишени.
Кальций. Еще один хорошо изученный второй по средник - внутриклеточный Са 2+ . Ионы Са 2+ по ступают в цитоплазму различными путями: по мембранным каналам (зависимый от G-белков, потенциалзависимый, регулируемый К + либо са-мим Са 2+), а также по каналам, расположенным в особых участках эндоплазматического ретикулума и открывающимся под действием ИФ 3 , а в скелетных мышцах - в результате деполяризации мембраны. Удаление кальция из цито плазмы происходит двумя путями: он по глощается эндоплазматическим ретикулумом или выводится из клетки. Са 2+ передает сигналы гораздо большему количеству белков, чем цАМФ, - фер-ментам, участвующим в клеточном метаболизме, протеинкиназам, кальцийсвязывающим белкам. Последние взаимодействуют с другими конечными и промежуточными эффекторами.
Регуляция рецепторов
Рецепторы не только управляют физиологическими и биохимическими функциями, но и сами служат объектами регуляции. Эта регуляция осуществляется на уровне синтеза и распада их макромолекул, посредством образования ковалентной связи с другими молекулами, взаимодействия с регуляторными белками, перемещения рецептора. Регуляции подвержены также белки-преобразователи и эффекторные белки. Регулирующие сигналы могут поступать от путей внутриклеточной передачи, активируемых при стимуляции самого рецептора (по механизму обратной связи), а также от других рецепторов (напрямую или опосредованно).
Длительная стимуляция рецепторов лекарственных средств обычно приводит к снижению реакции на него - в той же концентрации препарат вызывает менее выраженный эффект. Это явление, называемое десенситизацией, рефрактерностью, привыканием, играет важную роль в клинической практике: например, при длительном применении β-адреномиметиков для лечения пациентов с БА выраженность реакции на эти препараты уменьшается.
Гомологическая десенситизация касается только стимулированных рецепторов и специфична по отношению к лиганду. При гетерологичной десенситизации уменьшается выраженность реакции на другие лиганды, рецепторы которых действуют через тот же путь внутриклеточной передачи сигнала. В первом случае отрицательная обратная связь обеспечивается воздействием на сам рецептор (фосфорилирование, протеолиз, снижение синтеза), во втором случае помимо рецептора она может затрагивать и другие белки, участвующие во внутриклеточной передаче сигнала.
Напротив, если в течение продолжительноговремени рецепторы не стимулируются, их чувствительность к агонистам возрастает (например, при продолжительном лечении β-адреноблокатором пропронололом повышается чувствительность β-адренорецепторов к β-адреностимуляторам).
Заболевания, обусловленные нарушениями функции рецепторов
Помимо индивидуальных различий в чувствительности к лекарственным средствам существуют заболевания, обусловленные нарушением функции тех или иных компонентов механизма внутриклеточной передачи сигнала от рецептора к эффектору. При выпадении функции высокоспециализированых рецепторов фенотипические проявления заболевания могут быть ограниченными (например, при тестикулярной феминизации, связанной с генетическим обусловленным отсутствием или структурными дефектами андрогенных рецепторов). Если нарушен более универсальный механизм внутри клеточной передачи сигнала, симптомы болезни разнообразнее, как, например, при миастении и некоторых формах инсулинорезистентного сахарного диабета, вызванных соответственно аутоимунными нарушениями функции N-холинорецепторов и рецепторов инсулина. Дефекты какого-либо компонента, участвующего в передаче сигнала от многих рецепторов, приводят ко множественным эндокринным нарушениям. Примером может служить гетерозиготная форма дефицита белка G s , активирующего аденилатциктазу во всех клетках (Spiegel and Weinstein, 1995). Гомозиготная форма дефицита этого белка, вероятно, приводит к смерти.
Нарушения в структуре или локализации рецепторов могут проявиться ослабленной или усиленной реакцией на лекарственное средство, а также другими нежелательными эффектами.
Мутации, кодирующие рецепторы генов, способны изменять как реакцию на однократное применение препарата, так и эффективность длительного лечения. Например, дефект β-адренорецепторов, отвечающих за расслабление гладких мышц бронхов и регулирующих сопротивление дыхательных путей, усугубляет снижение чувствительности этих рецепторов к β-адреностимуляторам при длительном лечении пациентов с БА. По мере выявления мутаций, ответственных за нарушение функции рецепторов, и клонирования соответствующих генов появится возможность разработать методы лечения таких заболеваний.
Классификация рецепторов
Традиционно рецепторы лекарственных средств выявляли и классифицировали на основании эффектов и относительной активности действующих на эти рецепторы избирательных агонистов (стимуляторов) и антагонистов (блокаторов). Например, эффекты ацетилхолина, которые воспроизводятся при взаимодействии с холинорецепторами алкалоида мускарина и блокируются атропином, называют мускариновыми эффектами, а эффекты, которые воспроизводятся при взаимодействии с холинорецепторами никотина, - никотиновыми эффектами. Рецепторы, которые опосредуют действие мускарина и никотина, получили название соответственно М- и N-холинорецепторов. Хотя подобная классификация обычно не отражает механизм действия лекарственных средств, она удобна для систематизации их эффектов. Действительно, утверждение, что лекарственное средство стимулирует рецепторы определенного типа, одновременно определяет спектр эффектов данного препарата и вещества, усиливающие или ослабляющие эти эффекты. Однако правомочность таких утверждений может меняться с выявлением новых типов и подтипов рецепторов, открытием дополнительных механизмов действия лекарственных средств или ранее неизвестных побочных эффектов.
Подтипы рецепторов
С появлением все более разнообразных высокоизбирательных лекарственных средств стало ясно, что ранее известные типы рецепторов делятся на множество подтипов. Существенным подспорьем в изучении новых подтипов рецепторов стали методы молекулярного клонирования, а получение рекомбинантных рецепторов облегчило создание избирательно действующих на эти рецепторы лекарственных средств. Различные, но родственные подтипы рецепторов часто (хотя и не всегда) взаимодействуют с разными агонистами и антагонистами. Рецепторы, для которых избирательные агонисты и антагонисты не выявлены, обычно относятся не к отдельному подтипу, а к изоформам одного и того же рецептора.Отдельные подтипы могут различаться и по механизмам внутриклеточной передачи сигнала. М 1 - и М 3 -холинорецепторы, например, действуют через белок G q , который активирует фосфолипазу С опосредовано вызывает выброс Са 2+ из внутриклеточных депо, а М 2 - и М 4 -холинорецепторы - через белок G i , который ингибирует аденилатциклазу. Вместе с тем деление рецепторов на типы и подтипы зачастую определяется не механизмом действия, а случайным выбором или базируется на устоявшихся представлениях. Так, α 1 -, α 2 - и β- адренорецепторы различаются по реакции на лекарственные средства и по механизму передачи сигнала (активируют соответственно белки G i , G q и G s), хотя α- и β-адренорецепторы относятся к разным типам, а α 1 - и α 2 -адренорецепторы - к разным подтипам внутри одного типа. Изоформы α 1 -адренорецепторов - α 1А, α 1В и α 1D мало отличаются по своим биохимическим свойствам; тоже самое характерно и для изоформразных под-типов β-адренорецепторов (β 1 , β 2 и β 3).
Различия между подтипами рецепторов используют для создания высокоизбирательных лекарственных средств, например препаратов, оказывающих разное действие на одну и ту же ткань благодаря связыванию с подтипами рецепторов, различающихся механизмами внутриклеточной передачи сигнала. Кроме того, лекарственные средства могут избирательно воздействовать на определенные клетки или ткани, экспрессирующие рецепторы того или иного подтипа. Чем больше избирательность лекарственных средств (по отношению к определенной ткани или по отношению к определенному эффекту), тем более благоприятно соотношение его пользы и нежелательных эффектов.
С помощью молекулярно-генетических методов открыты не только разные изоформы рецепторов, но и гены, кодирующие новые, ранее не известные рецепторы. Многие из этих рецепторов уже отнесены к тому или иному известному классу, а их функция изучена с помощью соответствующих лигандов. Однако для некоторых рецепторов лиганды до сих пор не найдены.
Открытие множества изоформ одного и того же рецептора, кодируемых разными генами (особенно если изоформы не различаются по механизмам внутриклеточной передачи сигнала и взаимодействуют с одними и теми же эндоген-ными лигандами) позволяет независимо регулировать экспрессию рецепторов в разных клетках в соответствии с потребностями организма в разные возрастные периоды.
Действие лекарственных средств, не опосредованное рецепторами
Не все лекарственные средства действуют через макромолекулярные структуры - рецепторы. Некоторые препараты взаимодействуют с небольшими молекулами или ионами, присутствующими в организме в норме либо при том или ином патологическом состоянии. Так, антациды нейтрализуют соляную кислоту в желудке. Месна (лекарственное средство, которое быстро выделяется почками и нейтрализует свободные радикалы) связывается с активными метаболитами некоторых противоопухолевых средств, уменьшая выраженность побочных реакций со стороны мочевых путей. Ряд биологически малоактивных веществ (например маннитол) можно вводить в количествах, достаточных для повышения осмолярности биологических жидкостей, и таким образом менять распределение внеклеточной и внутриклеточной жидкости. С помощью этих веществ можно усилить диурез, увеличить ОЦК, устранить отек головного мозга. Кроме того, их применяют в качестве слабительных.
Некоторые лекарственные средства могут встраиваться в компоненты клетки и изменять их функции благодаря структурному сходству с входящими в состав этих компонентов веществ. Например, аналоги пуринов и пиримидинов встраиваются в нуклеиновые кислоты и используются в качестве противовирусных и противоопухолевых средств.
А.П. Викторов "Клиническая фармакология"
Подавляющее большинство лекарственных средств оказывает лечебное действие путем изменения деятельности физиологических систем клеток, которые вырабатывались у организма в процессе эволюции. Под влиянием лекарственного вещества в организме, как правило, не возникает новый тип деятельности клеток, лишь изменяется скорость протекания различных естественных процессов. Торможение или возбуждение физиологических процессов приводит к снижению или усилению соответствующих функций тканей организма.
Лекарственные средства могут действовать на специфические рецепторы, ферменты, мембраны клеток или прямо взаимодействовать с веществами клеток. Подробно механизмы действия лекарственных веществ изучаются в курсе общей или экспериментальной фармакологии. Ниже мы приводим лишь некоторые примеры основных механизмов действия лекарственных средств.
Действие на специфические рецепторы. Рецепторы - макромолекулярные структуры, избирательно чувствительные к определенным химическим соединениям. Взаимодействие химических веществ с рецептором приводит к возникновению биохимических и физиологических изменений в организме, которые выражаются в том или ином клиническом эффекте.
Препараты, прямо возбуждающие или повышающие функциональную активность рецепторов, называют агонистами, а вещества, препятствующие действию специфических агонистов, - антагонистами. Антагонизм может быть конкурентным и неконкурентным. В первом случае лекарственное вещество конкурирует с естественным регулятором (медиатором) за места связывания в специфических рецепторах. Блокада рецептора, вызванная конкурентным антагонистом, может быть устранена большими дозами вещества-агониста или естественного медиатора.
Разнообразные рецепторы разделяют по чувствительности к естественным медиаторам и их антагонистам. Например, чувствительные к ацетилхолину рецепторы называют холинергическими, чувствительные к адреналину - адренергическими. По чувствительности к мускарину и никотину холинергические рецепторы подразделяются на мускариночувствительные (м-холинорецепторы) и никотиночувствительные (н-холинорецепторы). Н-холинорецепторы неоднородны. Установлено, что их отличие заключается в чувствительности к различным веществам. Выделяют н-холинорецепторы, находящиеся в ганглиях автономной нервной системы, и н-холинорецепторы поперечнополосатой мускулатуры. Известны различные подтипы адренергических рецепторов, обозначаемые греческими буквами α1,α 2, β1, β2.
Выделяют также H1- и Н2-гистаминовые, допаминовые, серотониновые, опиоидные и другие рецепторы.
Влияние на активность ферментов. Некоторые лекарственные средства повышают или угнетают активность специфических ферментов. Например, физостигмин и неостигмин снижают активность холинэстеразы, разрушающей ацетилхолин, и дают эффекты, характерные для возбуждения парасимпатической нервной системы. Ингибиторы моноаминоксидазы (ипразид, ниаламид), препятствующие разрушению адреналина, усиливают активность симпатической нервной системы. Фенобарбитал и зиксорин, повышая активность глюкуронилтрансферазы печени, снижают уровень билирубина в крови.
Физико-химическое действие на мембраны клеток. Деятельность клеток нервной и мышечной систем зависит от потоков ионов, определяющих трансмембранный электрический потенциал. Некоторые лекарственные средства изменяют транспорт ионов.
Так действуют антиаритмические, противосудорожные препараты, средства для общего наркоза.
Прямое химическое взаимодействие. Лекарственные средства могут непосредственно взаимодействовать с небольшими молекулами или ионами внутри клеток. Например, этилендиаминтетрауксусная кислота (ЭДТА) прочно связывает ионы свинца. Принцип прямого химического взаимодействия лежит в основе применения многих антидотов при отравлениях химическими веществами. Другим примером может служить нейтрализация соляной кислоты антацидными средствами.



